佳维斯(武汉)生物医药有限公司
3 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Science | 组织透明化三维成像技术揭示控制成瘾的关键区域并解密了opioid的“大脑开关”
366 人阅读发布时间:2024-11-22 20:45
简介
在opioid 的滥用,特别是因其奖赏效应,已在美国导致药物过量死亡人数激增。opioid 产生奖赏效应的主要机制是通过刺激位于多巴胺神经元上的GABA介导的抑制性μ-opioid 受体(μORs),这些受体位于腹侧被盖区(VTA)。这种刺激导致伏隔核(NAc)和中脑-边缘系统其他部分的多巴胺传递被解除抑制。越来越多的证据表明,除了多巴胺系统外,还涉及其他不依赖多巴胺的机制。此外,对NAc的兴奋性毒性损伤显著减少了cocaine的自我给药行为,但对opioid 的操作反应仅略有减弱。这强调了非中脑-边缘大脑回路在opioid的动机属性中的重要性,但这些回路的具体身份尚不清楚。矛盾的是,引起奖赏行为的相同剂量的opioid也可能引发厌恶反应。对opioid和其他药物的厌恶反应在初次暴露后减少了形成习惯性使用模式的可能性。目前,大脑中决定opioid引发奖赏还是厌恶的机制大多尚未被探索。

一篇发表在Science上的文章提出假设,注射处方opioid oxycodone后,参与opioid奖赏和厌恶的小鼠神经元活动会发生变化。研究者刺激后,利用免疫组织化学染色方法结合组织透明化技术与光片显微镜成像,检测了c-Fos蛋白在大脑中的表达,发现oxycodone增加了腹侧前额叶皮层中相对未被探索的区域——背侧脚核(DPn)的神经活动,并通过光遗传学模拟DPn神经元活动会引发可被oxycodone注射阻断的厌恶行为状态。
研究发现DPn中存在一群投射到副脑桥核(PBn)的兴奋性神经元,这些DPn→PBn神经元通过其非典型的vGlut2和μORs表达与其他皮质谷氨酸能神经元区分开来。DPn→PBn神经元的激活有助于对opioid的厌恶反应,这些厌恶神经元的活动受到opioid直接抑制作用的限制。消除opioid对DPn→PBn神经元的直接抑制作用会使opioid变得高度令人厌恶。在依赖opioid的动物中,DPn神经元的活动也有助于戒断时的厌恶症状。这些发现表明DPn神经元在opioid的关键作用中至关重要,这些作用有助于opioid使用障碍(OUD)的发展和维持。
研究结果:
腹侧前额叶皮层包含opioid反应神经元:
为了探究opioid oxycodone对小鼠大脑,特别是腹侧前额叶皮层(ventral prefrontal cortex, vPFC)中神经元活动的调节作用。实验使用小鼠作为模型,通过注射oxycodone(5 mg/kg)或生理盐水,诱导条件性位置偏好(CPP)行为。注射后120分钟,收集小鼠的大脑样本,对大脑样本进行c-Fos的免疫染色,以标记oxycodone激活的神经元,并使用组织透明化处理以及全脑荧光成像,获取全脑c-Fos神经元分布,并 将c-Fos免疫阳性(Fos+)细胞映射到Allen Brain Atlas上,以确定oxycodone处理后神经活动增加的脑区。利用统计分析确定oxycodone处理组与对照组之间Fos+细胞密度的差异,并使用K-最近邻(KNN)和t-分布随机邻域嵌入(tSNE)分析来识别功能上可能相连的脑区。利用统计分析确定oxycodone处理组与对照组之间Fos+细胞密度的差异,并使用K-最近邻(KNN)和t-分布随机邻域嵌入(tSNE)分析来识别功能上可能相连的脑区(图1)。
结果发现,在oxycodone处理的小鼠中,与对照组相比,有28个脑区显示出Fos+细胞密度的显著增加,其中包括已知表达μORs的区域。在vPFC中,特别是DPn区域,观察到了c-Fos的强烈诱导,表明这一区域对oxycodone有响应。在vPFC中,特别是DPn区域,观察到了c-Fos的强烈诱导,表明这一区域对oxycodone有响应。通过KNN和tSNE分析,发现DPn与mPFC的IL和PrL区域,以及与调节对痛苦和压力刺激反应的脑区(如PBn、IPn和LC)在功能上可能相连(图1)。
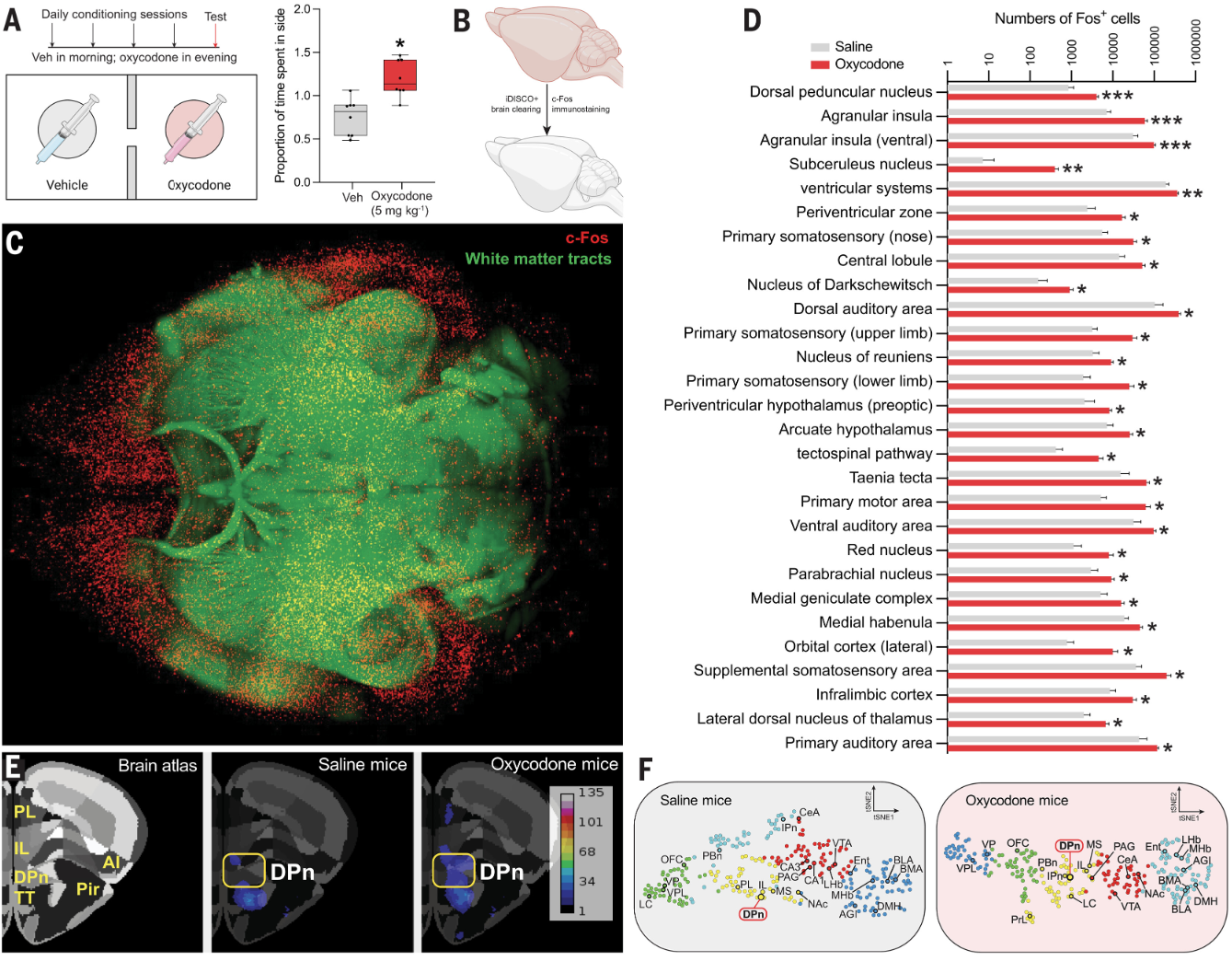
结果发现,在oxycodone处理的小鼠中,与对照组相比,有28个脑区显示出Fos+细胞密度的显著增加,其中包括已知表达μORs的区域。在vPFC中,特别是DPn区域,观察到了c-Fos的强烈诱导,表明这一区域对oxycodone有响应。在vPFC中,特别是DPn区域,观察到了c-Fos的强烈诱导,表明这一区域对oxycodone有响应。通过KNN和tSNE分析,发现DPn与mPFC的IL和PrL区域,以及与调节对痛苦和压力刺激反应的脑区(如PBn、IPn和LC)在功能上可能相连(图1)。

图1
opioid调节的 DPn 神经元对厌恶状态进行编码:
为探究背侧脚核(DPn)神经元如何响应opioid oxycodone,并确定这些神经元是否参与编码与oxycodone相关的厌恶状态(图2)。研究者使用AAV病毒载体将光敏感蛋白ChR2(channelrhodopsin-2)表达在DPn神经元中,以便通过光刺激精确激活这些神经元。使用FosTRAP2小鼠模型,特异性标记oxycodone激活的DPn神经元,该模型允许通过药物4-OHT(4-羟基他莫西芬)的处理来标记表达c-Fos的神经元。通过实时位置偏好(RTPP)测试,研究者评估了光刺激DPn神经元对小鼠行为的影响,以及这种影响是否可以被oxycodone注射所阻断。在DPn区域植入光纤,以实现对特定神经元群体的光刺激。
实验发现,实验结果表明DPn神经元不仅对oxycodone有响应,而且通过其与PBn的连接在编码厌恶状态中发挥关键作用。此外,这些神经元的激活状态受到oxycodone的直接调控,揭示了DPn在opioid奖赏和厌恶效应中的潜在双重作用。
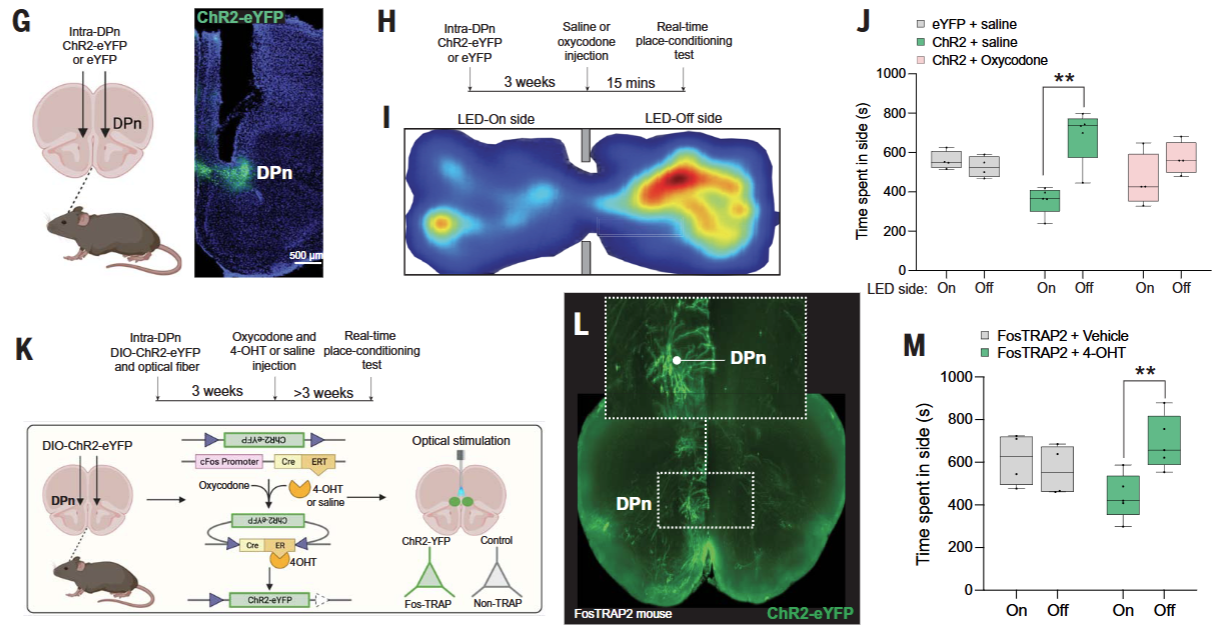
图2
连接组学分析识别离散DPn 神经元网络
通过对小鼠大脑进行连接组学分析,来识别和描述背侧脚核(DPn)神经元的特定网络。研究者特别关注DPn神经元如何与其他脑区连接,以及这些连接如何与opioid的奖赏和厌恶效应相关(图3)。通过注射oxycodone和4-OHT,研究者利用FosTRAP2系统特异性标记oxycodone激活的DPn神经元。注射AAV病毒载体使DPn神经元中表达荧光蛋白eYFP,结合组织透明化和光片显微成像,追踪这些神经元的轴突投射。实验结果显示,oxycodone激活的DPn神经元有特定的投射模式,这些神经元的轴突投射到了包括副脑桥核(PBn)在内的多个脑区。副脑桥核(PBn)有助于opioid引起的呼吸抑制和其他生理反应。PBn还调节对急性给予的opioid的厌恶反应。因此,研究者对受opioid调节的、投射到PBn的DPn神经元(DPn→PBn神经元)在奖赏相关行为中的作用进行研究。实验发现,oxycodone处理改变了DPn神经元在PBn和VTA中的投射强度,表明这些连接可能在调节对oxycodone的奖赏和厌恶反应中发挥重要作用。
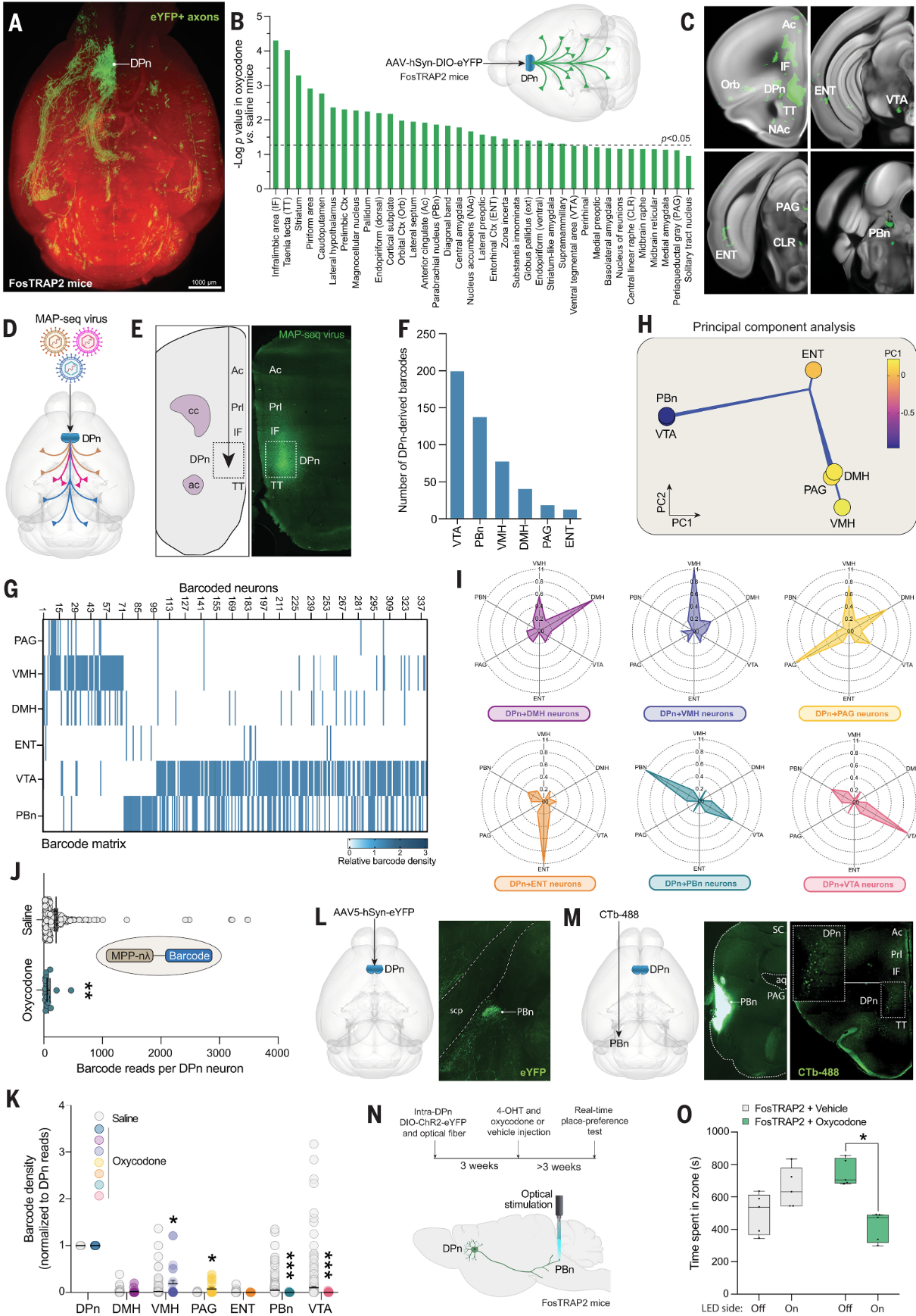
图3
DPn 包含群体PBn 投射锥体神经元:
这部分研究的目的是识别和表征DPn中那些投射到副脑桥核(PBn)的独特的锥体神经元群体,并探究它们在opioid诱导的奖赏和厌恶行为中的作用(图4)。
研究人员使用基于荧光原位杂交(FISH)的空间转录组学技术对C57BL/6J小鼠的前额叶皮层(PFC)进行分析,特别关注DPn区域。他们对1平方毫米的DPn区域进行了基因表达分析,使用120个标记基因来定义单细胞分辨率下的细胞表型。通过UMAP(Uniform Manifold Approximation and Projection)技术,研究人员将31,975个注释细胞根据它们的转录组轮廓分为不同的簇。每个分析的细胞都被映射到PFC中的精确位置,以确定不同类型细胞的空间分布。同时,研究人员发现DPn中含有一群独特的表达vGlut2的锥体神经元,这些神经元也表达μORs,这在皮层神经元中是不典型的。通过逆行示踪实验,研究人员确认了DPn中存在投射到PBn的神经元群体。 当DPn中的vGlut2+神经元被光刺激激活时,小鼠表现出厌恶行为,这一行为可以通过注射oxycodone来消除,表明这些神经元在编码厌恶状态中起着关键作用。
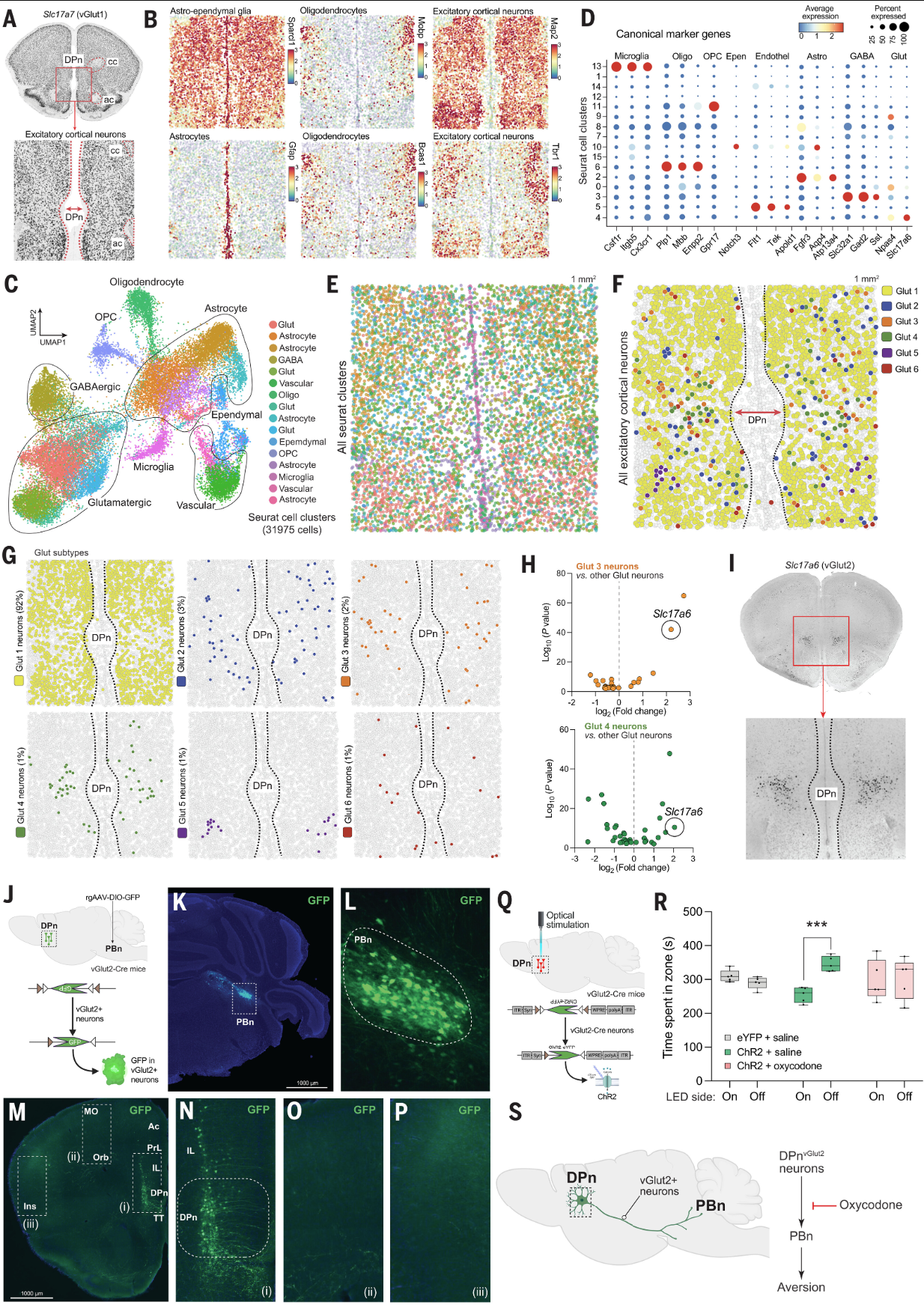
研究人员使用基于荧光原位杂交(FISH)的空间转录组学技术对C57BL/6J小鼠的前额叶皮层(PFC)进行分析,特别关注DPn区域。他们对1平方毫米的DPn区域进行了基因表达分析,使用120个标记基因来定义单细胞分辨率下的细胞表型。通过UMAP(Uniform Manifold Approximation and Projection)技术,研究人员将31,975个注释细胞根据它们的转录组轮廓分为不同的簇。每个分析的细胞都被映射到PFC中的精确位置,以确定不同类型细胞的空间分布。同时,研究人员发现DPn中含有一群独特的表达vGlut2的锥体神经元,这些神经元也表达μORs,这在皮层神经元中是不典型的。通过逆行示踪实验,研究人员确认了DPn中存在投射到PBn的神经元群体。 当DPn中的vGlut2+神经元被光刺激激活时,小鼠表现出厌恶行为,这一行为可以通过注射oxycodone来消除,表明这些神经元在编码厌恶状态中起着关键作用。

图4
DPn 锥体神经元表达μORs:
为了确定DPn中的锥体神经元是否表达μORs,并探究这些受体在opioid作用下的电生理特性(图5)。 研究人员使用snRNA-seq技术对小鼠DPn区域的细胞进行转录组分析,以确定不同细胞群体的基因表达模式。使用RNAscope FISH技术,研究人员发现DPn中的特定锥体神经元群体高表达μORs,这些神经元也表达vGlut2,这与典型的皮层锥体神经元不同。通过全细胞膜片钳技术记录DPn中μOR+锥体神经元的电生理特性,以及它们对opioid DAMGO的反应。结合光遗传学激活和行为测试,评估DPn中vGlut2+神经元在厌恶行为中的作用。电生理记录显示,DPn中的μOR+锥体神经元对DAMGO有反应,表现为超极化动作电位的减少和rheobase的增加,这表明这些神经元被opioid抑制。这部分研究揭示了DPn中的锥体神经元表达μORs,并且这些神经元参与了opioid引起的厌恶行为。这些发现为理解DPn在opioid效应中的作用提供了新的分子和细胞机制。
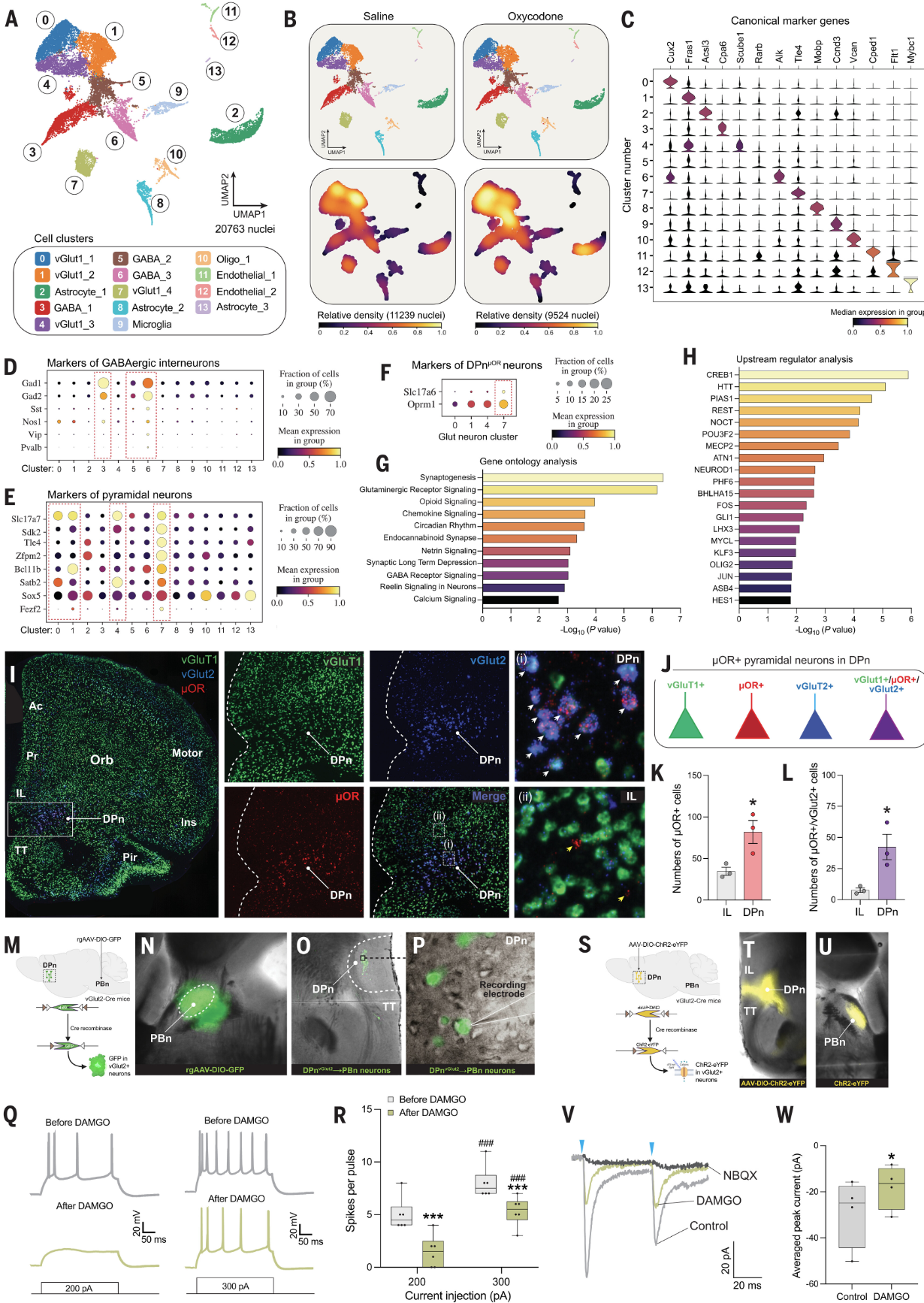
图5
DPn神经元调节opioid的快感价值与戒断反应:
这部分研究旨在确定DPn神经元在调节opioid引起的奖赏和厌恶反应中的作用,并探究这些神经元的活动如何影响opioid的快感价值(图6)。研究人员使用Oprm1fl/fl小鼠模型,通过AAV-Cre病毒在DPn中特异性敲除μ-opioid受体(μORs),以研究μORs在DPn中的函数。包括条件性位置偏好(CPP)测试和操作性条件反射测试,以评估小鼠对oxycodone的奖赏反应和食物奖励的行为。通过长期给予oxycodone建立小鼠的opioid依赖模型,并使用naloxone(opioid拮抗剂)诱导戒断反应。使用光遗传学和化学遗传学技术激活或抑制DPn神经元,以研究这些神经元在调节opioid效应中的作用。在DPn中特异性敲除μORs的小鼠(cKO小鼠)表现出对oxycodone的厌恶反应,与对照组小鼠相比,它们在CPP测试中避开了oxycodone的一侧。cKO小鼠在给予oxycodone后,对食物奖励的响应减少,表明DPn中μORs的缺失增强了oxycodone的厌恶效应。在长期给予oxycodone的小鼠中,激活DPn神经元加剧了naloxone诱导的戒断症状,而抑制DPn神经元则减轻了戒断症状。
研究表明DPn神经元通过表达μORs在调节opioid的快感价值中起着关键作用。DPn神经元的活动不仅影响opioid的奖赏效应,还参与调节opioid戒断时的厌恶症状。这些发现为理解DPn在opioid滥用和依赖中的作用提供了新的视角。
研究表明DPn神经元通过表达μORs在调节opioid的快感价值中起着关键作用。DPn神经元的活动不仅影响opioid的奖赏效应,还参与调节opioid戒断时的厌恶症状。这些发现为理解DPn在opioid滥用和依赖中的作用提供了新的视角。
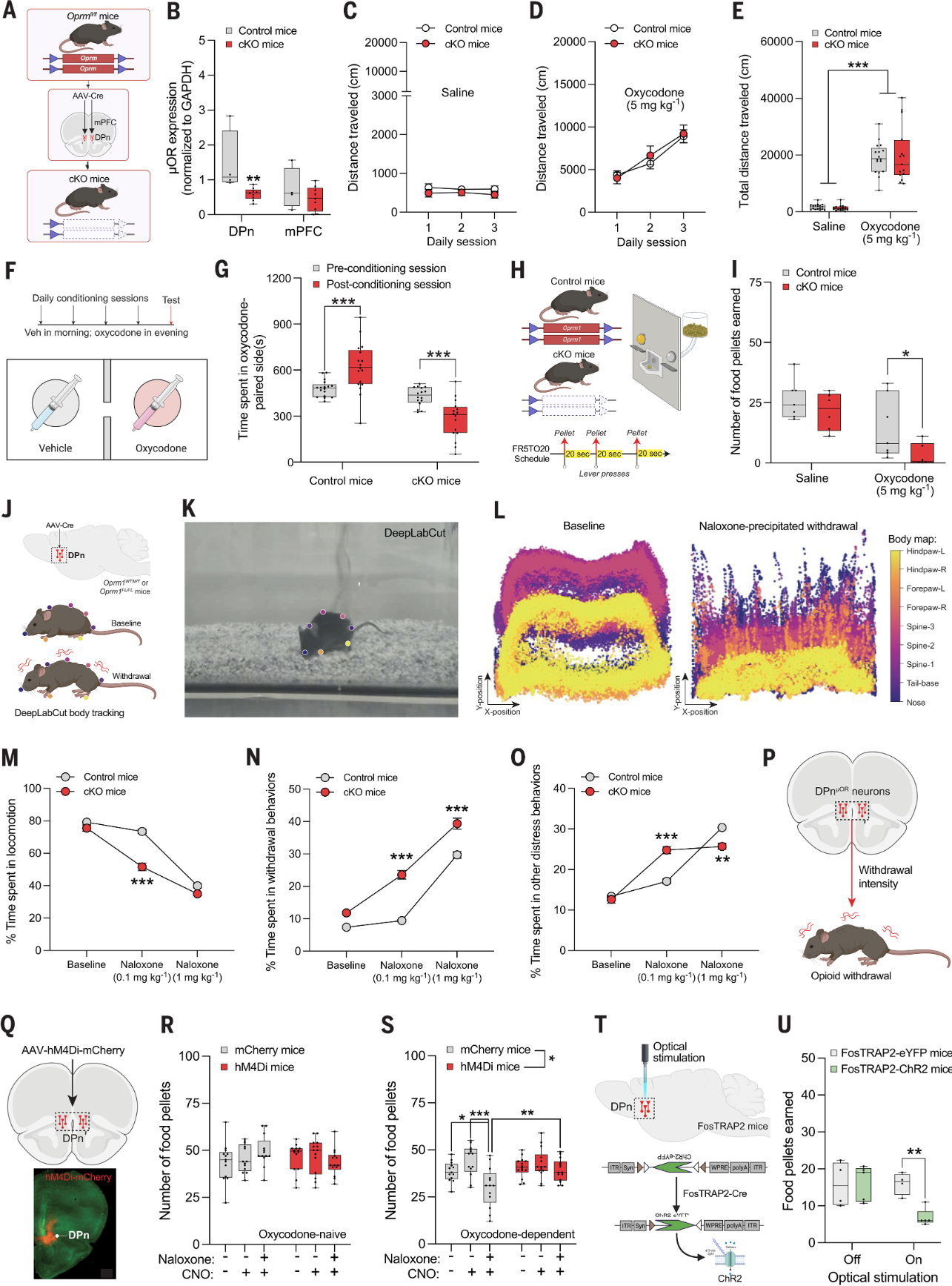
图6
总结
在本文中,研究者发现了大脑中一个关键的区域——背侧脚核(DPn),它在调节opioid的奖赏和厌恶反应中扮演着重要角色。这一发现不仅为理解opioid的成瘾机制提供了新的视角,也为未来的治疗提供了潜在的靶点。DPn中的神经元通过表达μ-opioid受体(μORs)直接参与了opioid的效应。当这些受体被激活时,它们可以引发奖赏感,但同时也可能产生厌恶反应,这种复杂的相互作用可能决定了个体是否会发展成药物依赖opioid在产生奖赏效应的同时,也能引发厌恶反应。这种厌恶反应实际上是一种保护机制,可以减少药物的滥用潜力。本文揭示了DPn神经元如何通过调节这种厌恶反应来影响个体对opioid的进一步使用。
在opioid依赖的小鼠模型中,研究者发现DPn神经元的活动增加与更严重的戒断症状有关。这一发现表明,通过调节DPn神经元的活动,可能有助于减轻戒断症状,为治疗opioid使用障碍(OUD)提供了新的策略。