佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Nature Biotechnology丨全鼠组织透明化实现单细胞分辨率小鼠全身纳米载体分布成像
439 人阅读发布时间:2025-05-08 18:27
现代生物医学领域已涌现出 RNA 分子、基因编辑工具及蛋白质药物等极具潜力的大分子药物,这些创新药物有望从根本上逆转人类疾病。然而,由于这类分子普遍存在体积大、带电荷的特性,导致其跨越生物屏障的难度极大。如何实现向特定细胞类型的精准递送,并最大限度降低脱靶效应,已成为制约其临床转化的关键瓶颈。
为攻克这一难题,科研人员广泛采用纳米载体(如脂质纳米颗粒 LNP)对药物分子进行包裹。这种技术不仅能够有效保护药物分子免受降解,还可通过修饰实现特定组织或细胞的靶向递送。但纳米载体进入人体后,会不可避免地与血浆蛋白结合形成 “蛋白质电晕”,这一现象会显著改变纳米载体的生物分布特性及其与细胞的相互作用模式,进一步加剧了纳米药物设计与评估的复杂性。
2025年1月14日,慕尼黑亥姆霍兹中心智能生物技术研究所Roger团队在《Nature Biotechnology》发表了文章“Nanocarrier imaging at single-cell resolution across entire mouse bodies with deep learning”,将组织透明化与三维成像与深度学习算法相结合,能够在单细胞分辨率下对整个小鼠体内的纳米载体分布进行全面量化。尤其值得关注的是,该平台在极低剂量(0.0005 mg/kg)的条件下也能追踪LNP分布,突破了传统全身成像技术的灵敏度限制。
Part.01
优化后的DISCO组织透明化技术:助力低剂量纳米载体成像
传统的生物发光成像是常见的全身成像手段,在高剂量(0.5 mg/kg)注射mRNA载体时,可以检测到较强的荧光素酶信号,具备良好的器官级对比度(图1b)。然而,当注射剂量降低至mRNA疫苗常用的水平(0.0005 mg/kg)(图1c)时,成像信号急剧减弱,难以捕捉有效的生物分布信息。
为解决这一瓶颈,研究团队基于临床批准的MC3可电离脂质,构建了携带EGFP mRNA的LNP,并使用Alexa 647或Alexa 750荧光染料进行标记。在此基础上,他们优化了DISCO组织透明化流程,从样本固定、脱脂、折射率匹配等多个环节入手,有效保留了荧光信号强度,使得在低剂量条件下的三维成像成为可能。图1a展示了SCP-Nano工作流程:这是一种结合组织透明化和光片显微镜的方法,能够实现对任何荧光标记纳米载体在全身范围内的三维分布绘制和定量分析,具备单细胞分辨率和高灵敏度。
具体成像结果如下:
● 图1b、1c显示,静脉注射0.5 mg/kg和0.0005 mg/kg荧光素酶mRNA-LNP后6小时的小鼠体内生物发光图像;
● 图1d–f展示,注射0.0005 mg/kg EGFP mRNA-LNP并经优化DISCO清除处理后,使用光片显微镜获得的小鼠全身3D成像。可见,LNP成功递送至肝脏(e)和脾脏(f)等部位,信号清晰可辨;
● 图1g–m则呈现了经鼻给药后(0.0005 mg/kg)LNP在小鼠体内的分布情况,包括最大强度投影图(g)及多个组织的单张光学切片(h–l),其中图m为肺部的代表性切片。
这一技术突破不仅显著提升了成像灵敏度,也为分析极低剂量纳米药物在动物体内的分布提供了工具支持。
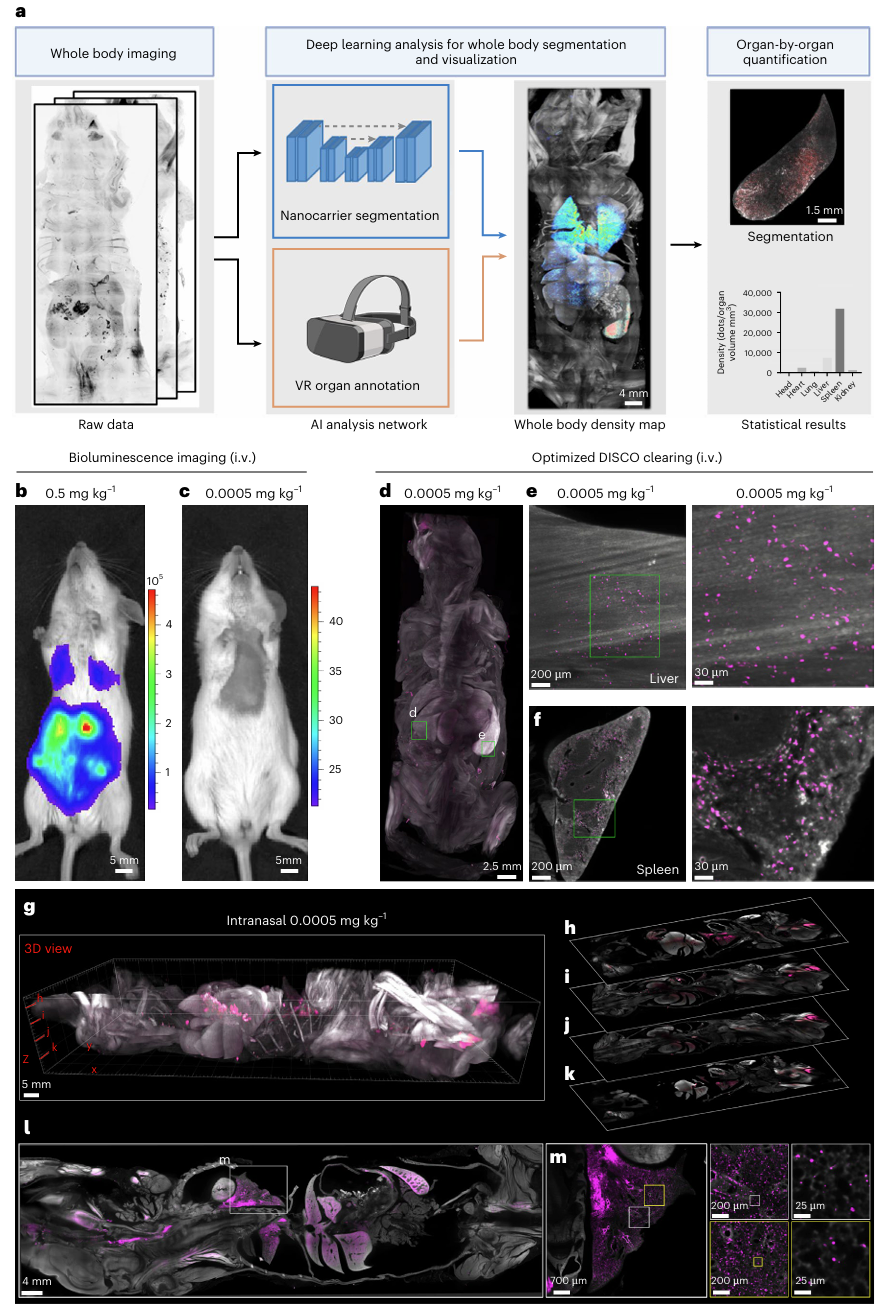
图1 优化DISCO透明化技术用于低剂量纳米载体成像
Part.02
基于AI的LNP靶向细胞水平定量分析
为了在现有计算资源的内存限制内有效处理全身成像数据,研究团队将三维成像数据划分为若干离散小单元(图2a)。他们采用了虚拟现实(VR)辅助注释方法构建训练数据集,该方法相比传统的基于切片的注释方式,能更高效准确地进行三维空间中的细胞标注。训练数据集覆盖了肌肉注射与静脉注射LNP后的多个器官,包括头部、心脏、肺、肾脏、肝脏、淋巴结与脾脏,共计31个三维块,每块尺寸约为200×200×200到300×300×300体素。
为了评估模型在不同组织中的分割性能,数据集被手动划分为训练集、验证集和测试集,使用实例级F1分数(instance F1 score)作为主要性能指标。研究者对多个先进的三维图像分割网络进行了系统比较,包括VNet、U-Net++、Attention U-Net、UNETR、SwinUNETR、nnFormer和3D U-Net。最终,表现最佳的模型为基于3D U-Net架构的网络,其特点为:
● 6个编码层 + 5个解码层;
● 使用Leaky ReLU作为激活函数;
● 在五折交叉验证的基础上训练,确保模型稳健性(图2b)。
在独立测试集上,SCP-Nano系统平均实例F1分数达到0.7329,各器官的分数范围为0.6857至0.7967,显示了其在不同组织环境下都具备良好的细胞识别与分割能力。
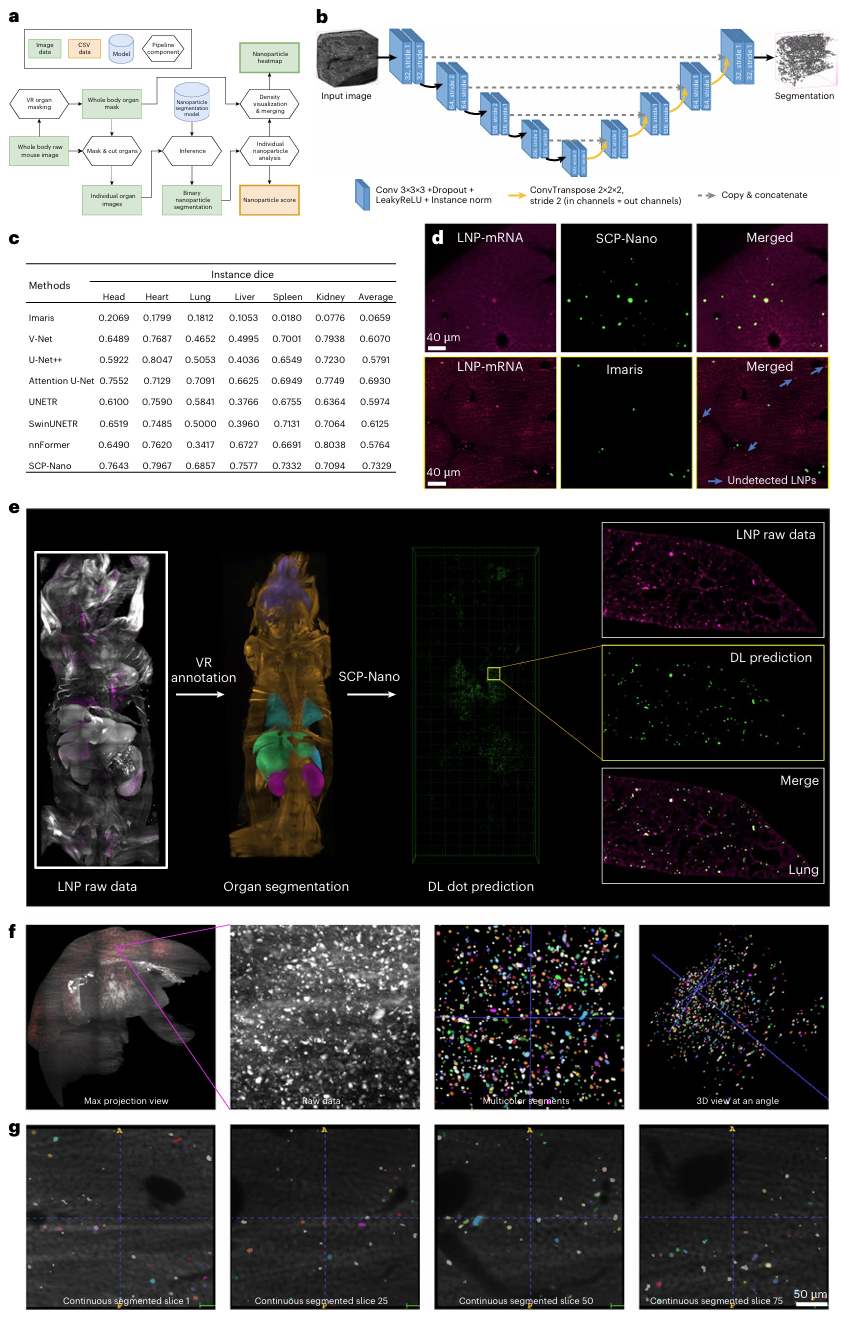
图2 SCP-Nano基于深度学习流程进行细胞分割和分析
Part.03
SCP-Nano 揭示不同给药途径下LNP的组织趋向性
研究团队利用SCP-Nano平台系统分析了不同给药途径对脂质纳米颗粒(LNP)体内分布的影响。具体而言,他们将携带荧光标记EGFP mRNA的LNP以极低剂量(0.0005 mg/kg)分别通过以下方式注射入小鼠体内:肌肉注射(i.m.)、皮内注射(i.d.)、静脉注射(i.v.)、鼻内滴注(i.n.)、口服给药(p.o.)。每种途径设置3只小鼠(n=3),在注射后6小时进行组织成像分析。
为便于定性对比,研究者基于SCP-Nano的单细胞识别能力,构建了整个小鼠身体的LNP递送密度热图(图3a)。结果显示,不仅不同器官之间存在明显的递送效率差异,而且同一器官内部也呈现出显著异质性。
更为重要的是,SCP-Nano所具备的高分辨率能够识别出传统方法难以察觉的器官内“热点区域”(图3b,白色箭头所示),如肝脏、脾脏中某些区域的LNP积聚尤为显著。
在此基础上,研究团队进一步使用深度学习算法,对关键器官的mRNA递送事件进行量化分析(图3c)。通过器官级别的统计(n = 每组3只小鼠,数据以平均值±标准差表示),揭示了各给药途径下的靶向特点,为后续纳米递送策略的优化提供了重要参考。
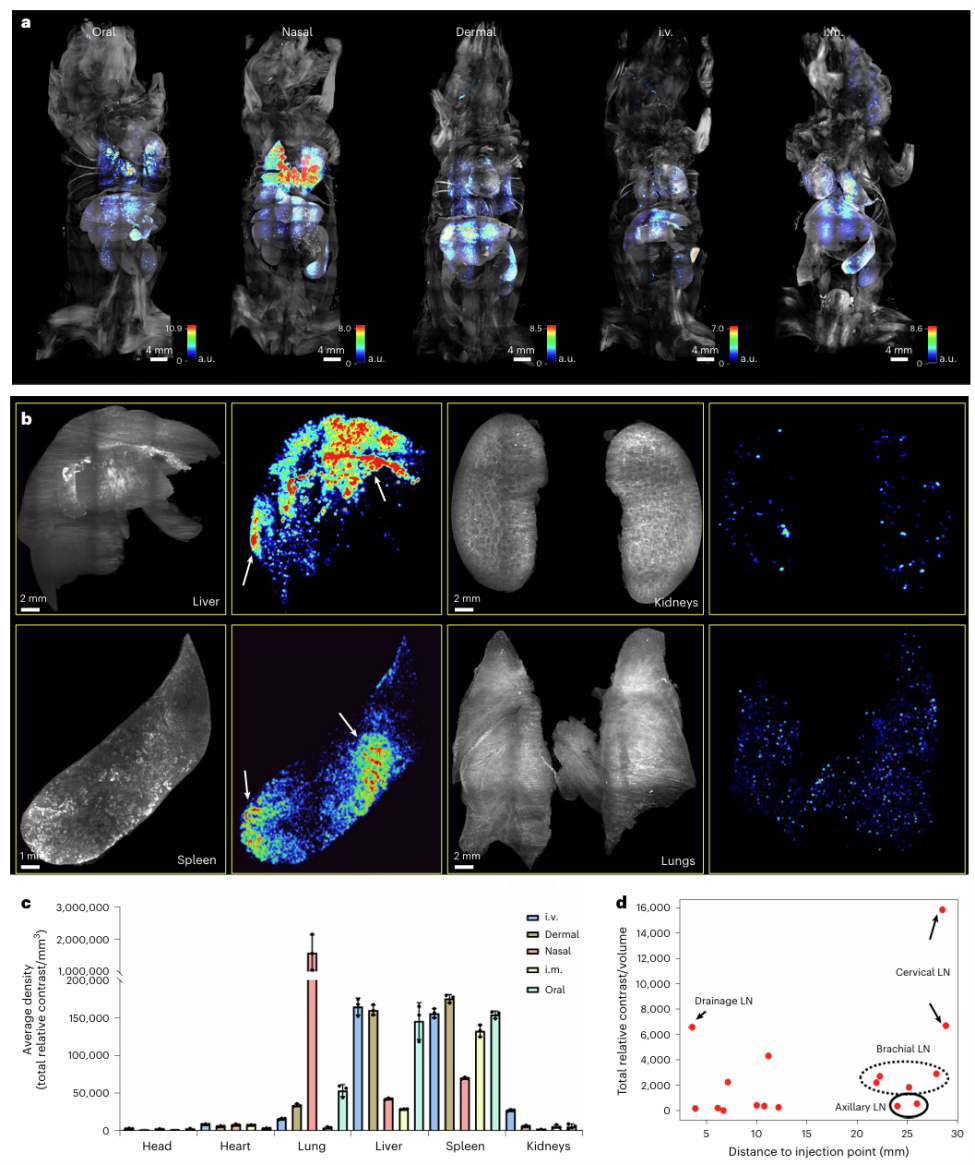
图3 SCP-Nano揭示了基于不同应用途径的LNP生物分布的差异
Part.04
SCP-Nano 精准量化两种 AAV 的细胞靶向特异性
研究团队进一步应用 SCP-Nano 平台,评估两种常用 AAV(腺相关病毒)变体在小鼠体内的靶向特性:Retro-AAV:AAV2 的改造型,具备神经元逆行转导能力;PHP.eB-AAV:AAV9 的工程化变体,专门优化用于穿越血脑屏障(BBB),用于中枢神经系统(CNS)的靶向递送。研究者分别将编码 EGFP 的两种 AAV 注射入小鼠体内(Retro-AAV:肌肉注射;PHP.eB-AAV:静脉注射),在注射后 2 周,通过灌注和组织透明化处理,使用 SCP-Nano 进行全身三维成像与单细胞量化分析。
PHP.eB-AAV 分布情况(图4a–e):
● 在全身范围内可见广泛 EGFP 表达(图4a);
● 主要聚集于大脑(图4b)、海马区(图4c)、脊髓(图4d)及特定淋巴结(图4e),显示出典型的 CNS 靶向模式。
Retro-AAV 分布情况(图4f–j):
● 在脂肪组织区域表达尤为突出,包括后肢皮下(图g)、输尿管附近(图h)、腹壁(图i)和颈部脂肪组织(图j);
● 提示 Retro-AAV 具有强烈的脂肪组织亲和性,为脂代谢疾病的基因治疗提供可能。
研究进一步基于 SCP-Nano 对上述两种 AAV 衍生的 EGFP 表达细胞进行定量分析(图4k):
● PHP.eB-AAV 在脑组织中的靶向效率约为 Retro-AAV的 40 倍;
● 在脑内的空间分布也呈现出显著的区域异质性(图4l):使用 DELiVR工具将数据映射到 Allen Brain Atlas CCF3参考图谱;图中以 log2 转换的EGFP+细胞密度表示区域差异,红色为高密度,蓝色为低密度;数据可视化采用BrainRender渲染。
为进一步提升分析精度,研究者还手动标注了一个小型验证数据集(16个patch),并据此微调模型,最终在该任务上的平均实例 F1 分数达到 0.8019。
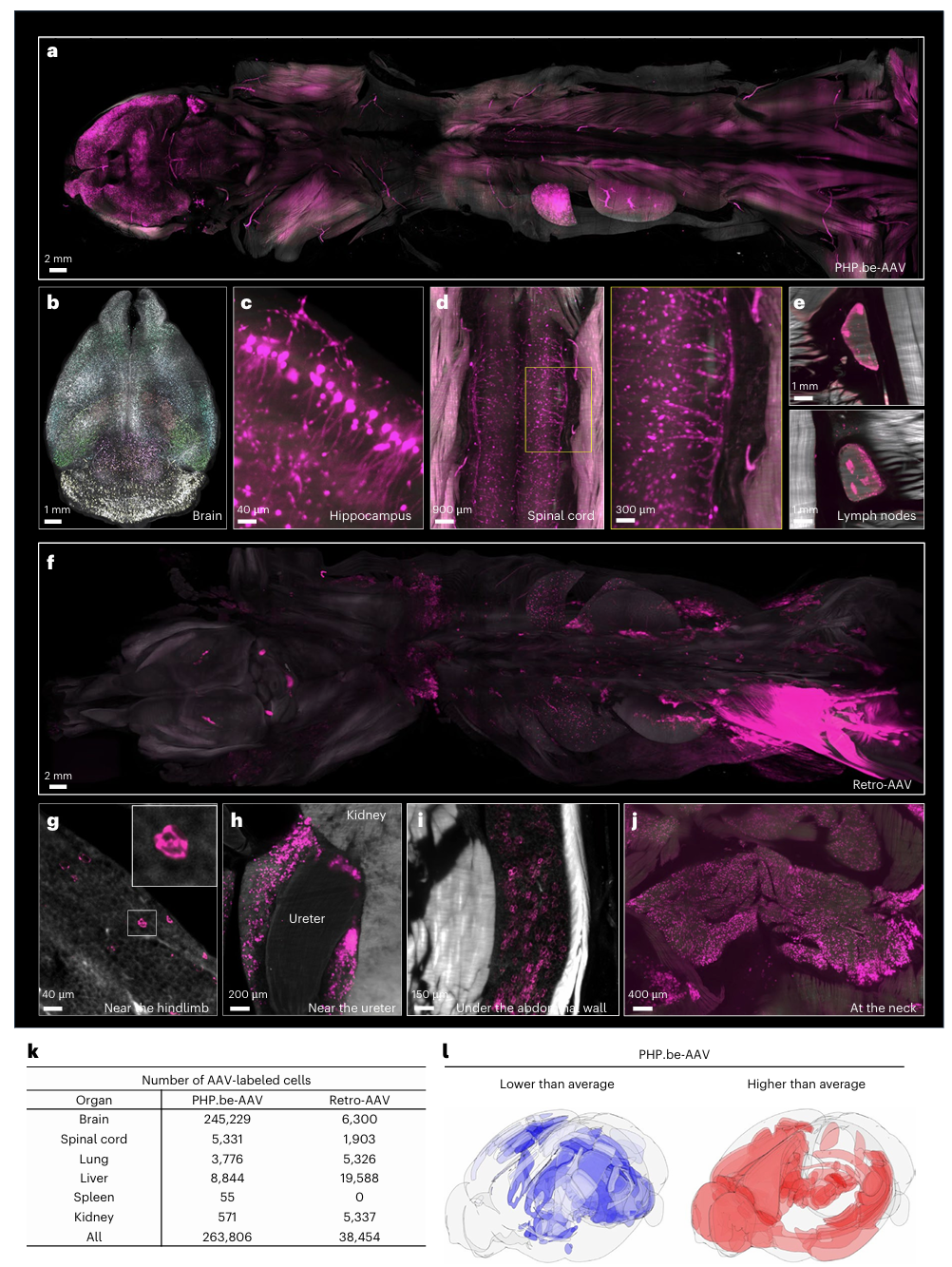
图4 SCP-Nano量化了两种AVV的靶向特异性