佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
客户文章【Biomaterials】丨组织透明化三维成像技术揭示了一种全新的可用于心梗治疗的药物传送系统
16 人阅读发布时间:2025-12-19 09:32

心肌梗死作为全球范围内导致死亡和残疾的主要原因之一,其病理过程涉及复杂的免疫炎症反应和心室重构。尽管经皮冠状动脉介入治疗(PCI)和冠状动脉旁路移植术(CABG)等再灌注疗法能够有效恢复心肌血液供应,但它们无法彻底解决心肌缺血后的免疫炎症反应问题。因此,开发能够调控心肌梗死后免疫微环境、促进心脏修复的新型治疗策略显得尤为重要。近日,上海交通大学瑞金医院心血管外科的研究团队在《Biomaterials》杂志上发表了一项具有里程碑意义的研究,题为“LNPs-mediated VEGF-C mRNA delivery promotes heart repair and attenuates inflammation by stimulating lymphangiogenesis post-myocardial infarction”。该研究通过创新性的脂质纳米颗粒(LNP)平台,实现了VEGF-C mRNA在心肌梗死(MI)后的高效递送,显著促进了心脏修复并减轻了炎症反应,为心肌梗死的治疗开辟了新的路径。
01 首先作者构建了由DOTAP、磷脂、胆固醇、DMG-PEG和棕榈酸组成的LNP系统。棕榈酸的引入是关键创新之一,其羧基可与细胞外基质相互作用,延长LNP在心肌组织的滞留时间。通过筛选6种不同摩尔比例的配方(I-VI),研究者发现添加5%棕榈酸的Formulation I在粒径、PDI、Zeta电位和包封效率上表现最优,粒径约100 nm,包封率高达85%。 Cryo-TEM图像清晰展示了LNPs的球形核壳结构,形态均一,稳定性良好,能在心梗后的酸性微环境中保持稳定。(图1)。
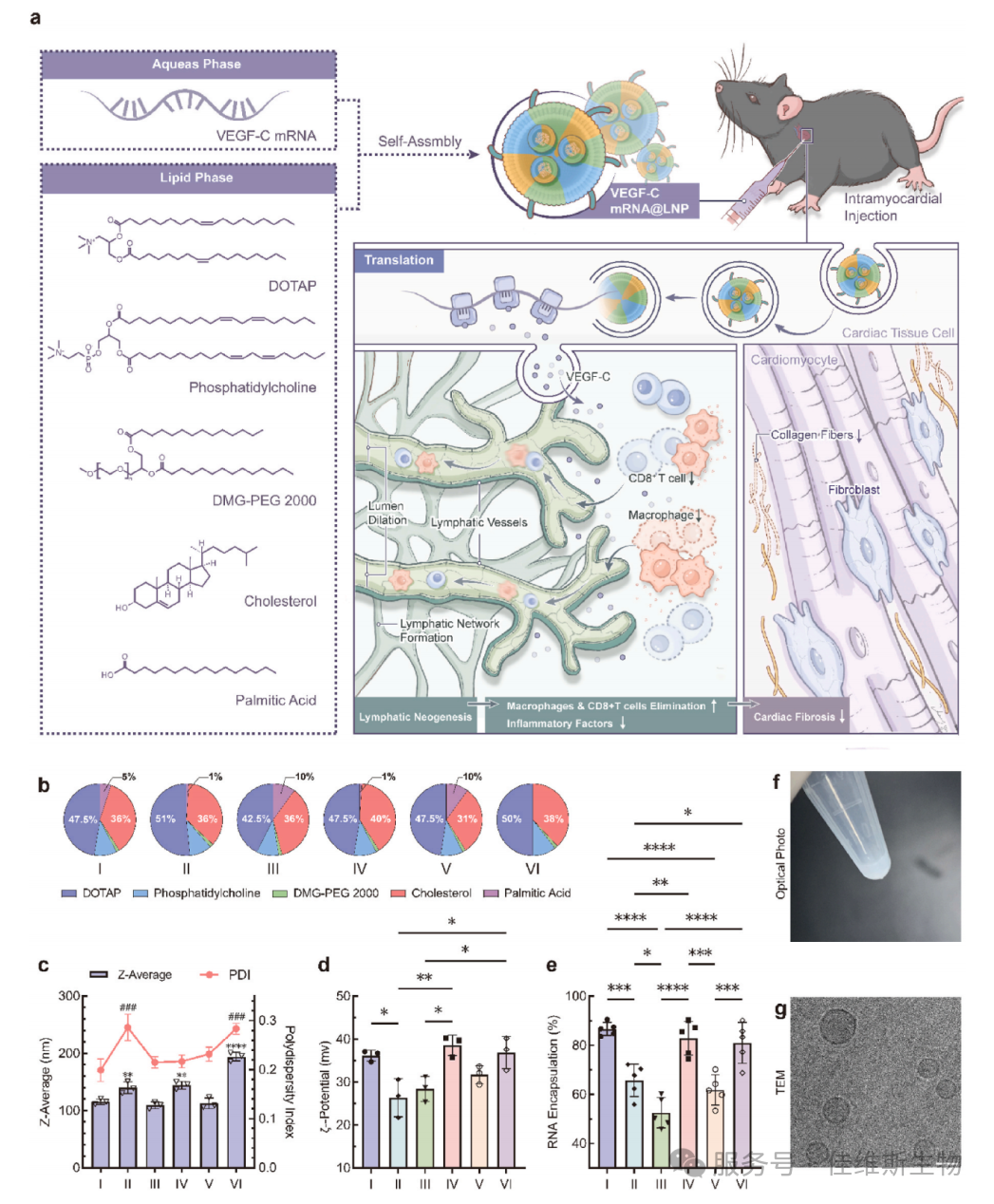
图1 LNP的理性设计与系统优化
02 接下来研究者系统评估了LNP的递送效率和生物安全性。通过细胞毒性实验表明,在250 μg/mL浓度下,对多种细胞系活力影响较小;溶血实验证明其血液相容性良好,安全浓度下溶血率<10%。Western blot和荧光素酶报告系统证实,VEGF-C mRNA@LNPs能在细胞内高效表达功能蛋白,其效率显著高于裸mRNA。共聚焦显微镜动态追踪可见LNPs在4小时内与内体共定位(黄色斑点),6小时后成功逃逸至胞质(红色信号),这解释了其高转染效率的机制—高效的内体逃逸能力。体内成像显示,心肌注射后Luc mRNA@LNPs的表达可持续至少48小时,为干预急性炎症期提供了足够长的治疗窗口(图2)。
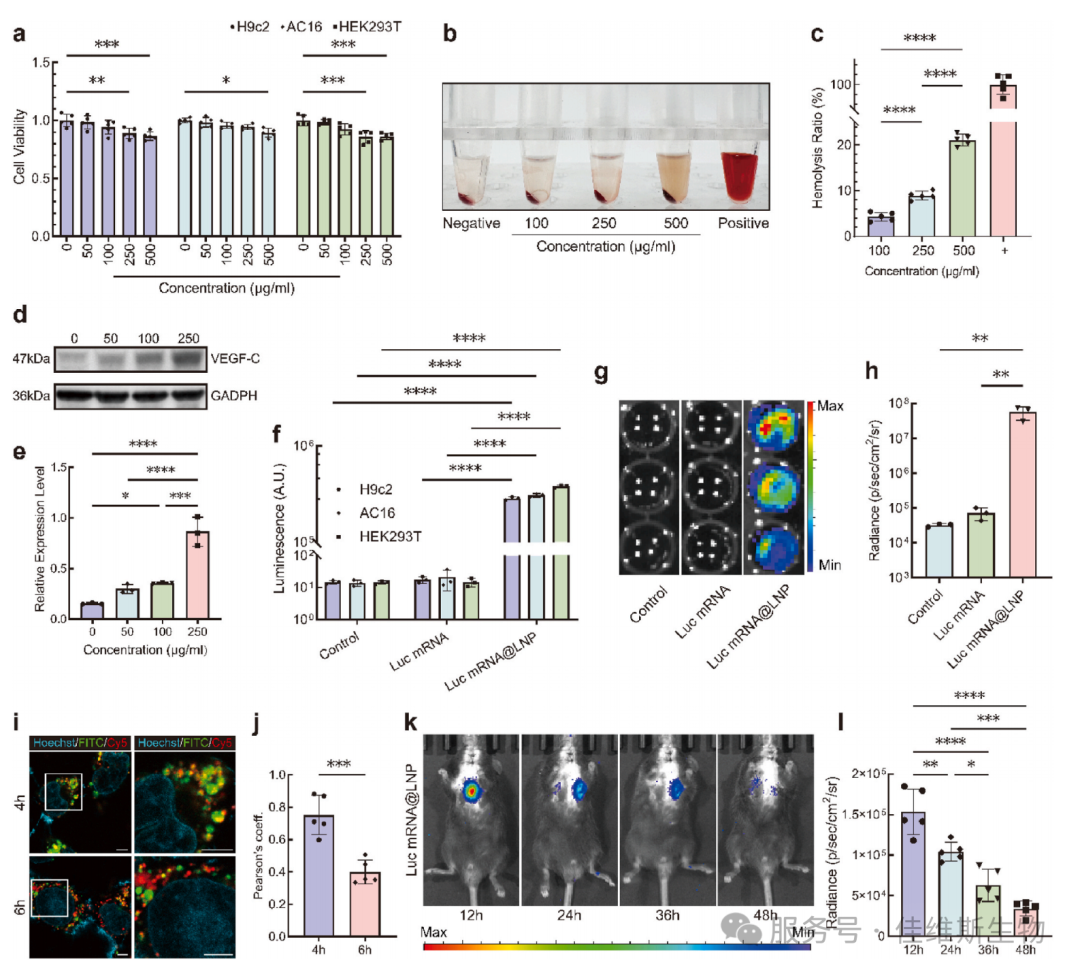
图2 高效、安全的体内外递送验证
03 心梗后的急性炎症主要由M1型促炎巨噬细胞驱动。研究者深入探究了VEGF-C的免疫调节功能。将经VEGF-C条件培养基处理的淋巴管内皮细胞(SVEC4-10)与M1型巨噬细胞共培养后,发现M1标志物(iNOS)显著下降,而M2标志物(CD206)上升。流式细胞术进一步证实CD86+ M1细胞比例下降。转录组测序(RNA-seq)、热图、GO分析和GSEA分析一致表明,共培养后的M1巨噬细胞其干扰素响应通路和“antiviral response” 等典型M1特征通路被显著抑制,而组织修复相关基因上调。这表明VEGF-C通过作用于淋巴管内皮细胞,间接诱导了巨噬细胞从促炎向修复表型的重编程(图3)。
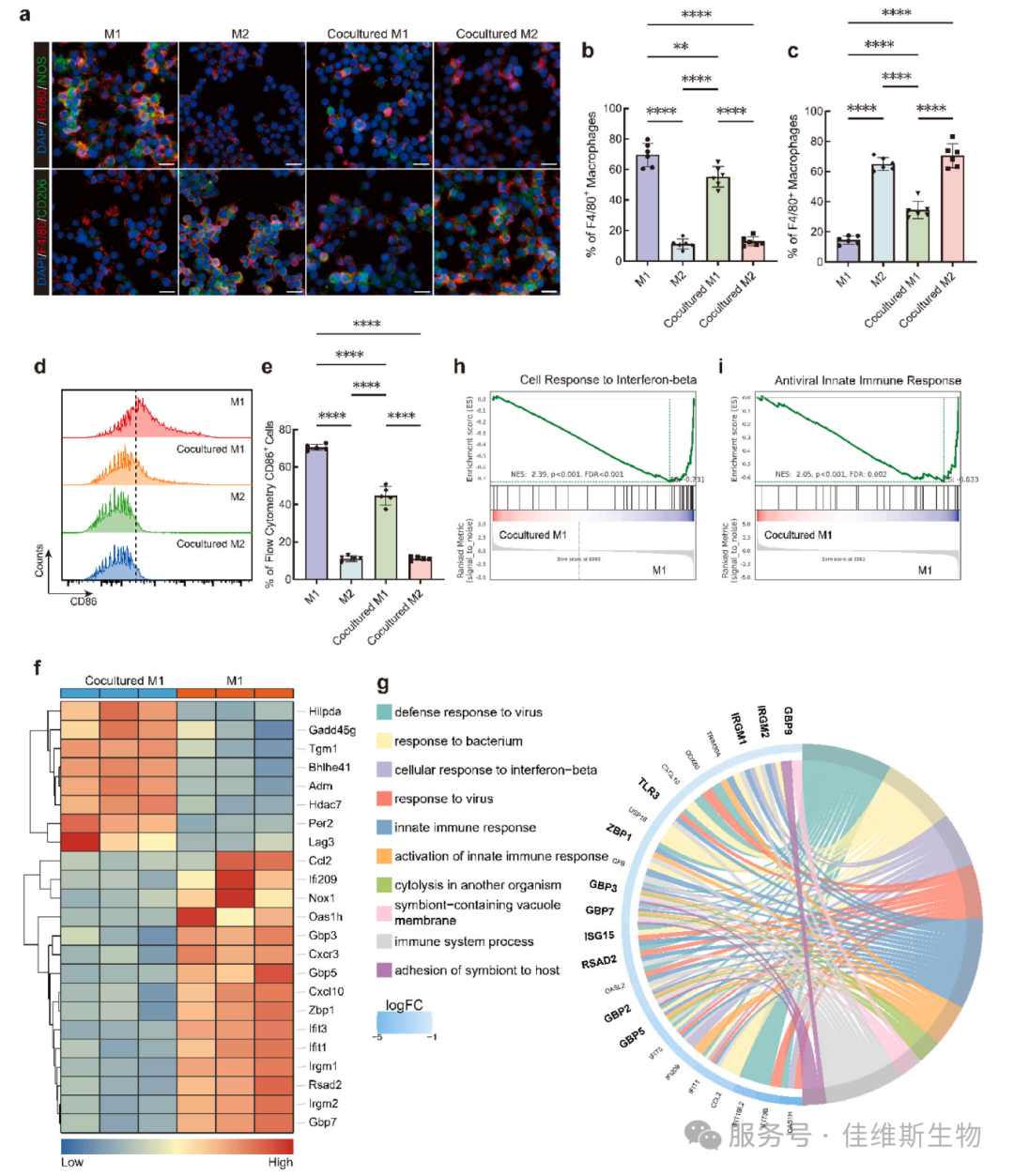
图3 调控巨噬细胞极化的机制探索
04 随后研究者在心梗小鼠模型中验证了治疗效果。通过组织透明化FDISCO结合光片荧光显微镜成像技术,研究者清晰地看到,治疗组心脏梗死周边区的淋巴管网密度和淋巴管直径(~30 μm)显著大于MI对照组(~20 μm)。更粗的淋巴管意味着更强的引流能力。免疫荧光染色显示,治疗组中LYVE-1+的淋巴管增多,而CD68+巨噬细胞和CD8+ T细胞的浸润显著减少。相关性分析表明,淋巴管密度与免疫细胞数量呈显著负相关,直接证明了功能性淋巴管在清除炎症细胞中的关键作用(图4)。
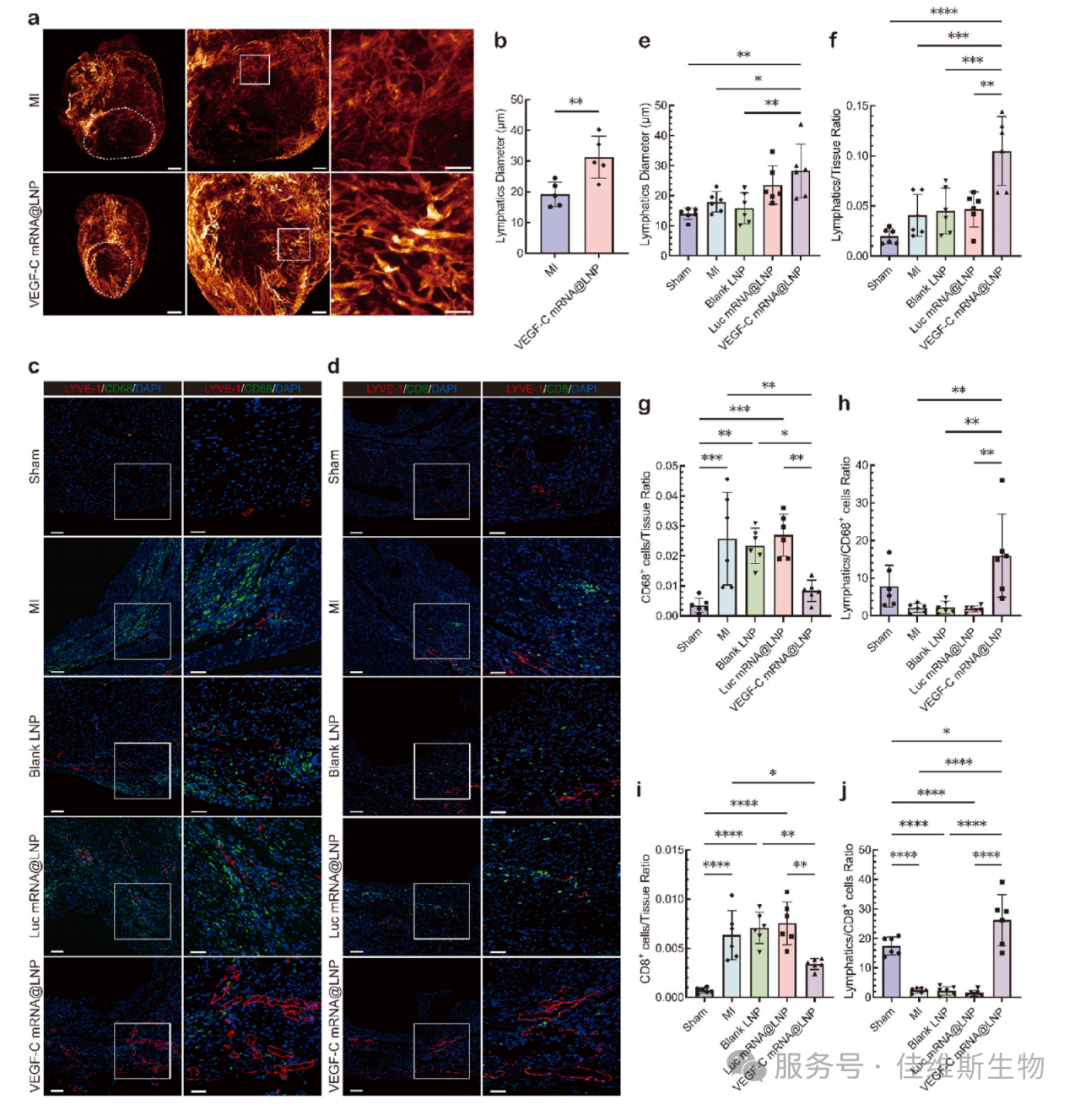
图4 促进淋巴管新生并缓解免疫浸润
05 治疗的最终目标是改善心脏功能和解剖结构。生存分析显示,治疗组小鼠28天生存率得到改善。超声心动图数据显示,治疗组在心梗后7天和28天的左室射血分数(LVEF)和短轴缩短率(LVFS)均显著高于对照组,表明心脏收缩功能得到长期保护。Masson三色染色显示,治疗组梗死面积显著减小,心室壁厚度得以保留,抑制了不良重构。原子力显微镜(AFM)检测发现梗死区组织的杨氏模量(硬度)降低,同时心脏水含量下降。这两项指标分别从生物物理和生理角度证实了治疗减轻了纤维化僵硬度和心肌水肿(图5)。
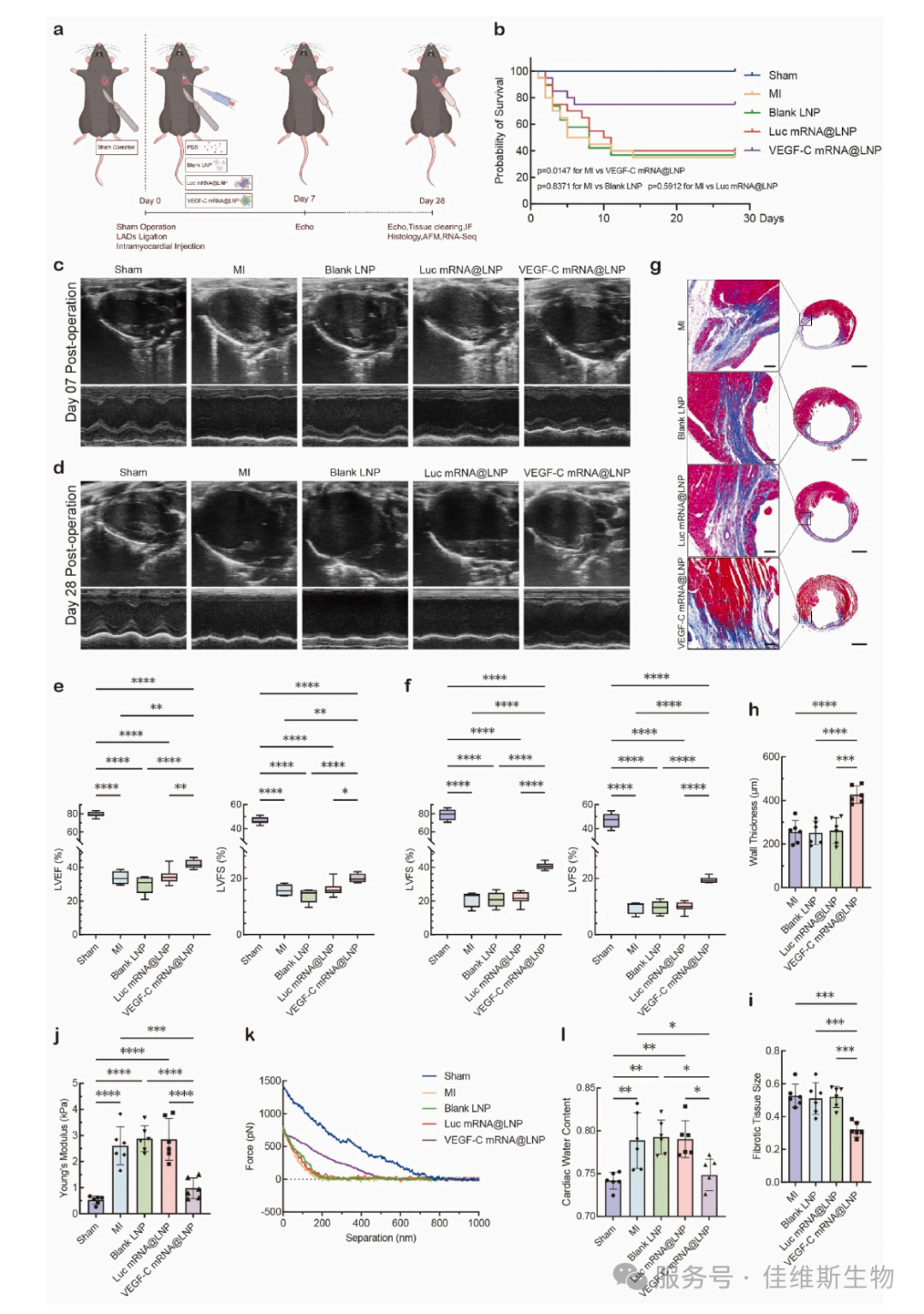
图5 心脏功能与组织学全面改善
06 为了从全局视角理解治疗机制,研究者对心脏组织进行了RNA-seq分析。
热图显示,治疗组中多个促纤维化基因(Col16a1, Tgfb3, Timp2)、炎症基因(Cxcl10, Rcan1) 和促重构基因(Loxl1, Acta2) 被下调,而心肌代谢相关基因(Per3, Camk2a) 被上调。KEGG通路富集分析发现,TGF-β信号通路、ECM-受体相互作用、TNF信号通路等负面通路被抑制,而心肌收缩、血管平滑肌收缩等有益通路被激活。GSEA分析再次从基因集层面验证了治疗对纤维化过程的抑制作用(图6)。
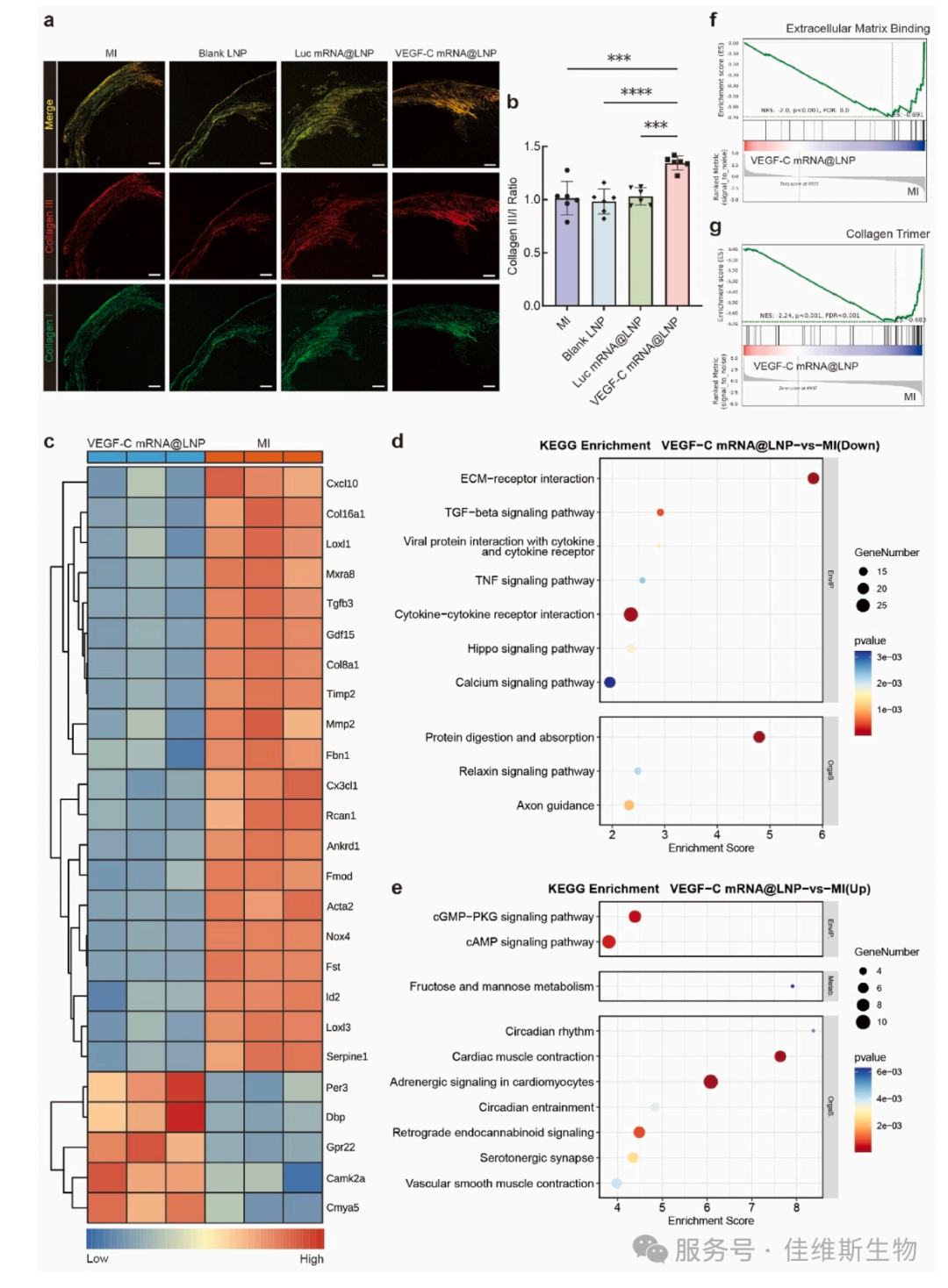
图6 多组学分析揭示分子通路调控
总结
本研究成功开发了一种安全高效的VEGF-C mRNA@LNP系统,其通过:
01 时空可控的蛋白表达,克服了重组蛋白半衰期短、需反复给药的缺点;
02 双管齐下的治疗机制,既通过淋巴管新生引流水肿和炎症细胞,又通过免疫调节抑制过度炎症;
03 多重改善心脏结局,最终实现了减轻纤维化、改善心脏结构和功能的综合疗效。
这项研究为心梗后免疫调节性治疗提供了全新的思路和强大的技术平台,具有重大的临床转化前景。
为评估心脏淋巴管整体结构变化,研究采用组织透明化技术(由佳维斯(武汉)生物医药有限公司提供),结合光片显微成像技术,实现心脏淋巴管空间结构的三维可视化:采用三维免疫荧光染色技术实现对心脏淋巴管进行整体免疫荧光标记,利用FDISCO组织透明化方法对心脏组织进行高效透明,结合光片显微镜获取心脏淋巴管高分辨三维空间结构信息,进而定量评估心脏梗死周边区的淋巴管网密度和淋巴管直径变化,突破了传统病理的二维限制,验证淋巴管在心脏疾病中关键作用。
关于佳维斯