佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Nature Communications | 调控社交传递疼痛模型中疼痛抵抗表型的关键环路
551 人阅读发布时间:2024-07-11 09:19
为了阐明疼痛背后的机制,2024年6月10日,徐州医科大学江苏省麻醉学重点实验室张红星、曹君利教授团队与深圳理工大学韩明虎教授合作在《Nature Communications》杂志上发表文章揭示通过社交传递的疼痛模型中调控疼痛抵抗的神经环路机制。作者采用社交疼痛转移模型(STA, socially transferred allodynia)的标准范式,通过检测疼痛的两个临界标准机械爪缩阈值(PWT,paw withdrawal thresholds)和PWT 比率将 STA小鼠分为疼痛敏感型和疼痛抵抗型。STA 抵抗小鼠的 VTA 中谷氨酸能神经元的活性升高,这是一个参与介导疼痛和社会行为的常见大脑区域,此外,作者还确定了与这些神经元相关的下游神经环路在发展和维持对STA 抵抗方面的功能。
01 STA后易感和抵抗小鼠的特征
作者让旁观者小鼠BY(bystander)与STA疼痛小鼠进行社交互动后发现雄性C57BL / 6J旁观者(BY)小鼠表现出PWTs的显着降低(von Frey测量值),其中~70%的BY小鼠表现出减少的PWT(BY-S易感鼠),而剩余~30%的PWTs表现出与对照小鼠相当的PWT(BY-R抵抗鼠),这种社交传递的疼痛敏感和抵抗表型可稳定存在1到2周(图1)。
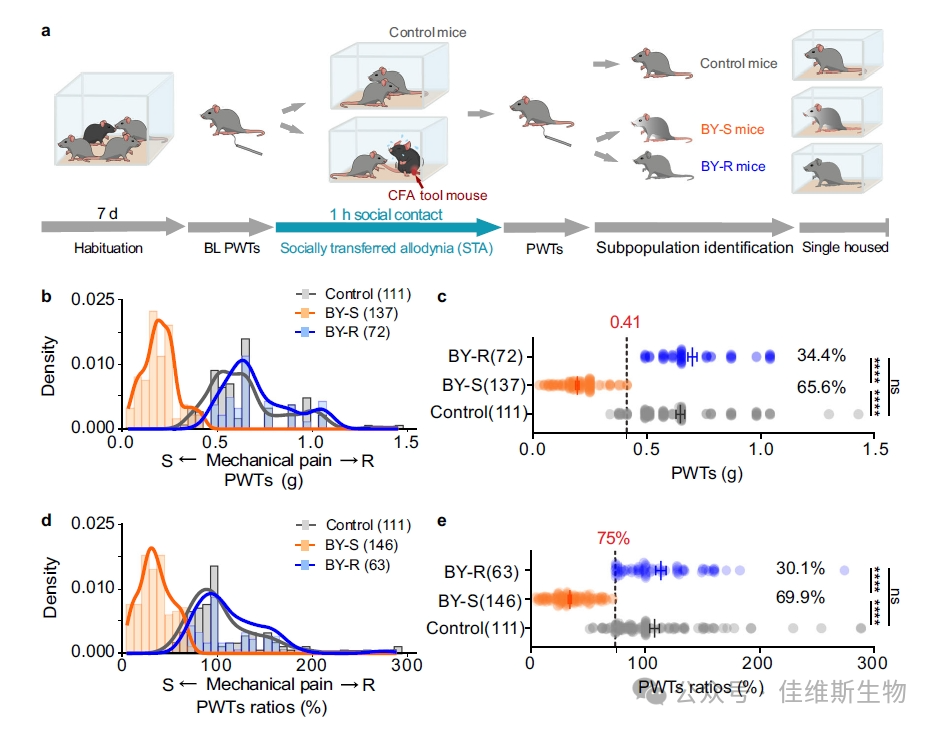
图1. 疼痛模型存在易感小鼠和抵抗小鼠两种表型
02 抵抗小鼠的VTAGlu的神经元激活
接下来,作者寻找与STA抵抗相关的大脑区域。为此,作者对小鼠进行社交接触和von Frey测试后,在小鼠的大脑中用c-Fos蛋白抗体进行免疫荧光,发现腹侧被盖区VTA中的c-Fos蛋白表达水平仅在BY-R小鼠中特异性增加。VTA核团存在多种神经元类型,通过在局部表达Cre诱导型rAAV-DIO-EGFP的Vgat-IRES-Cre或Vglut2-IRES-Cre小鼠中进行的进一步免疫组织化学实验表明,BY-R小鼠中VTA谷氨酸能神经元(兴奋性神经元)中被显著激活,为了进一步确认BY-R小鼠中VTA谷氨酸能神经元的过度活跃,作者在Vglut2-IRES-Cre小鼠中用携带mCherry的Cre病毒标记这些神经元后进行膜片钳检测。功能验证结果表明,与对照组或BY-S组相比,BY-R小鼠中VTA mCherry阳性神经元的放电频率增加。这些数据表明,VTA谷氨酸能神经元可能参与大脑中对STA的抵抗。
03 通过激活VTAGlu神经元促进小鼠STA的抵抗
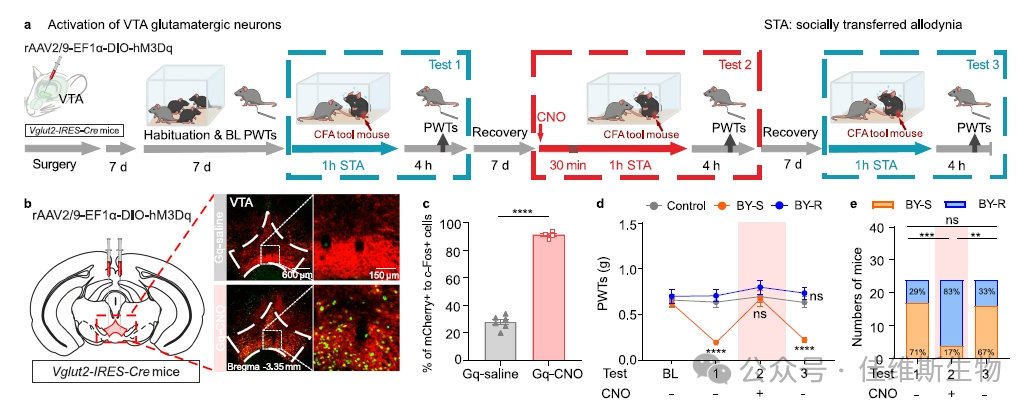
图2.VTA谷氨酸能神经元的激活促进STA的抵抗
04 VTA谷氨酸能神经元的抑制促进STA的易感性
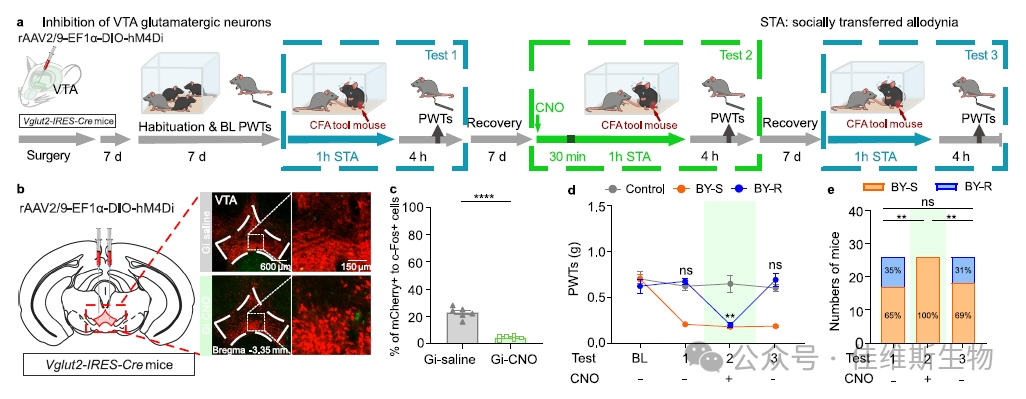
图3.VTA谷氨酸能神经元的抑制促进对STA的易感性
05 VTAGlu环路以不同方式调节小鼠疼痛抵抗表型的形成
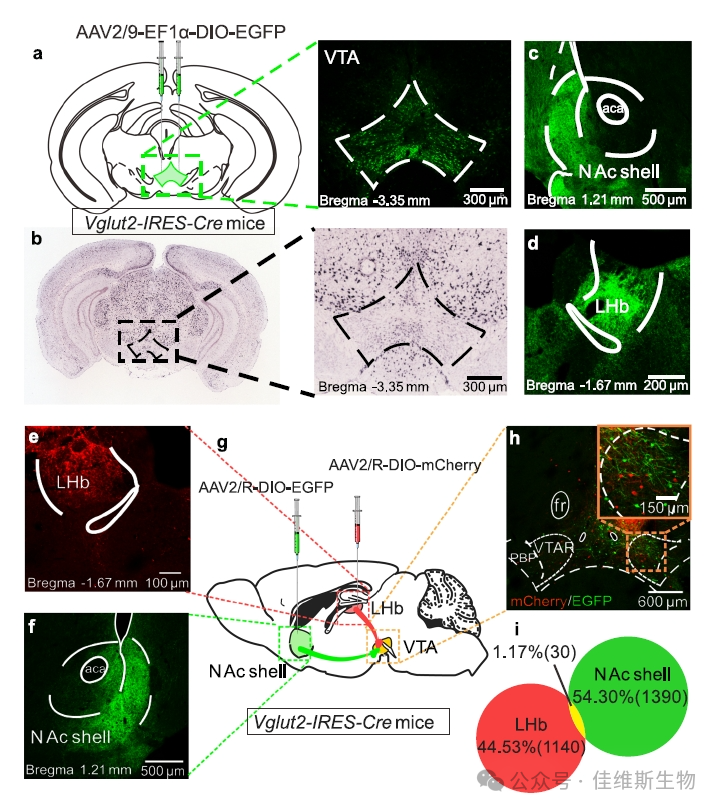
图4.投射到NAc和LHb的VTA谷氨酸能神经元来自不同的亚群
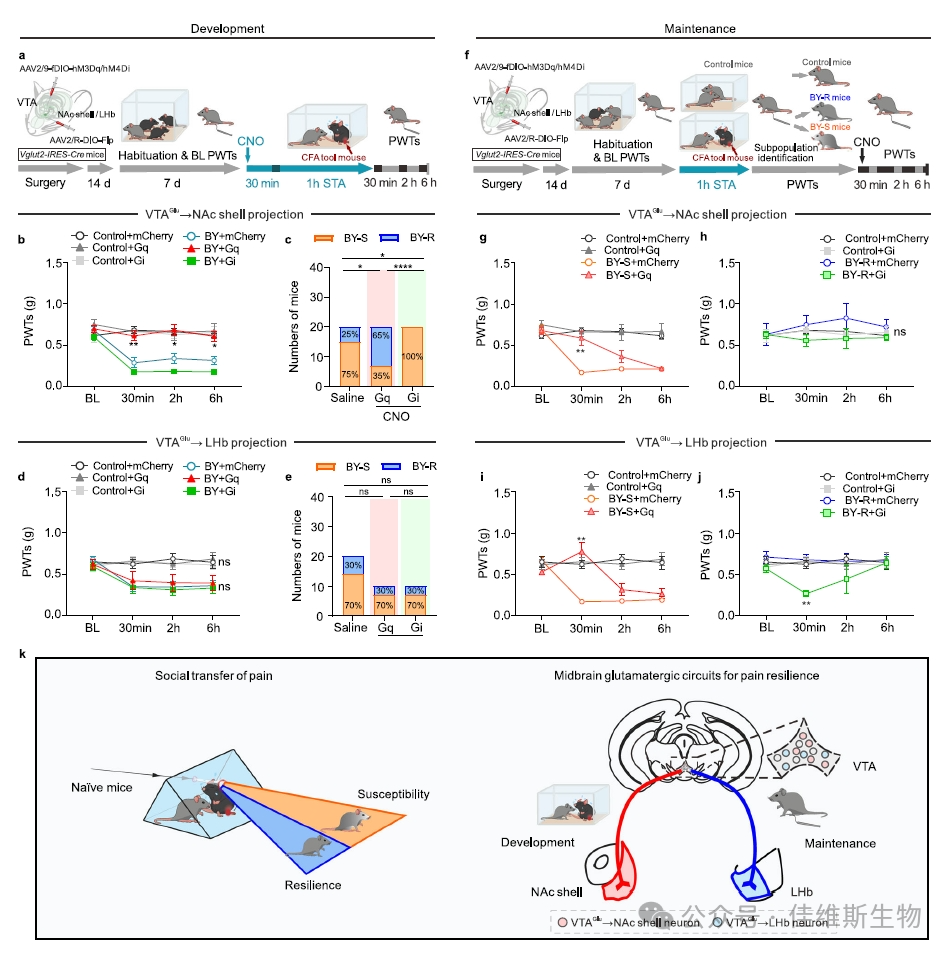
总结
参考来源:
Han Y, Ai L, Song L, et al. Midbrain glutamatergic circuit mechanism of resilience to socially transferred allodynia in male mice.Nat Commun. 2024;15(1):4947. Published 2024 Jun 10. doi:10.1038/s41467-024-49340-8