佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Nature 丨组织透明化三维成像揭示正常胰腺和胰腺癌组织神经分布差异
466 人阅读发布时间:2025-05-27 09:36

近日,德国海德堡干细胞技术与实验医学研究所联合多家科研机构在《Nature》期刊发表突破性研究成果。研究团队成功研发出新型"Trace-n-seq"技术,首次在单细胞水平上对胰腺组织中的神经支配进行了分子特征解析,系统比较了正常胰腺与胰腺癌组织的神经分布差异。该研究首次揭示胰腺癌细胞能够通过分子机制"重塑"周围神经元的功能状态,改变其分子特征和生理功能。这一重要发现为深入探究肿瘤微环境中神经元与癌细胞的互作机制提供了全新视角,或将推动胰腺癌靶向治疗方案的创新。该成果不仅拓展了人们对肿瘤微环境复杂性的认知,更为发展基于神经-肿瘤相互作用的新型抗癌策略奠定了理论基础。
JARVIS
多种神经元类型支配胰腺
为了在三维水平上分析小鼠胰腺神经元的分布,作者使用了iDISCO组织透明化技术与光片荧光显微成像(LSFM)技术,利用周围蛋白(PRPH,全神经元标记)、酪氨酸羟化酶(TH,交感神经标记)和降钙素基因相关肽(CGRP,感觉神经标记)进行标记与定量分析。作者研发了名为Trace-n-Seq的技术:通过手术将荧光逆行示踪剂Fast Blue (FB) 注射至目标器官(如胰腺),标记出支配目标器官的神经元,随后通过FACS分选出FB+的神经元进行单细胞RNA测序(scRNA-seq),以探究神经元亚型及分子特性。研究发现背根神经节感觉神经元在胰腺内分布较交感神经元更均匀,且存在异质性亚型。通过优化逆行示踪技术,证实75-90%颈上神经节神经元和4-15%胸段背根神经节神经元投射至胰腺,并首次发现部分神经元可同时支配多个器官。该技术为研究外周神经系统的器官特异性支配提供了新方法(图1-2,补充图1-3)。
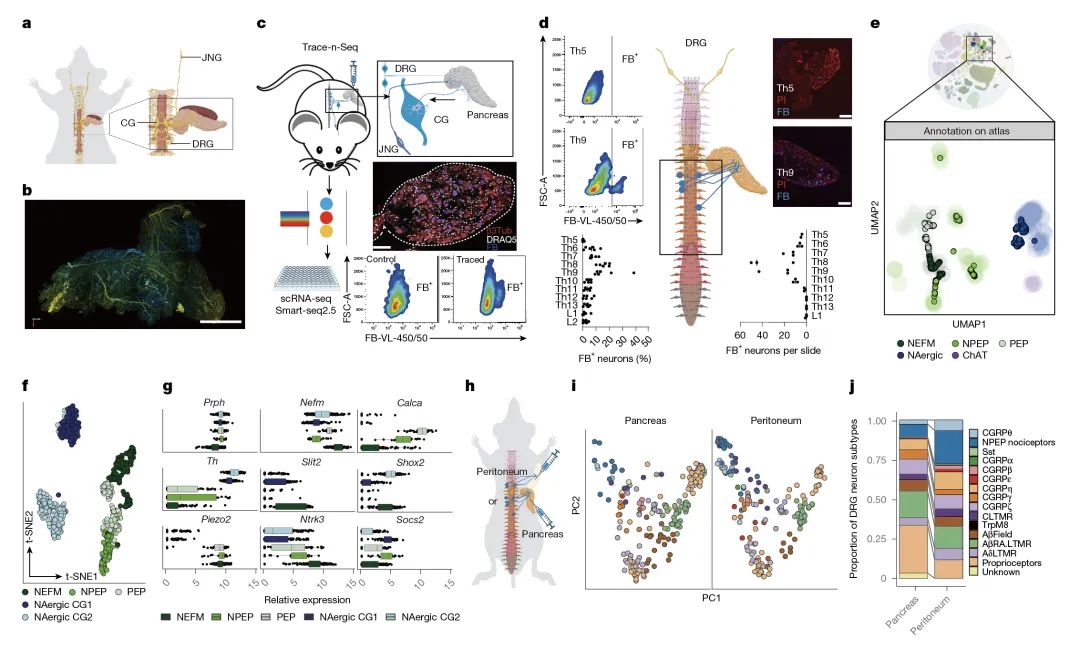
图1 通过 Tracen-Seq 确定胰腺神经元的特征
✦
•
✦
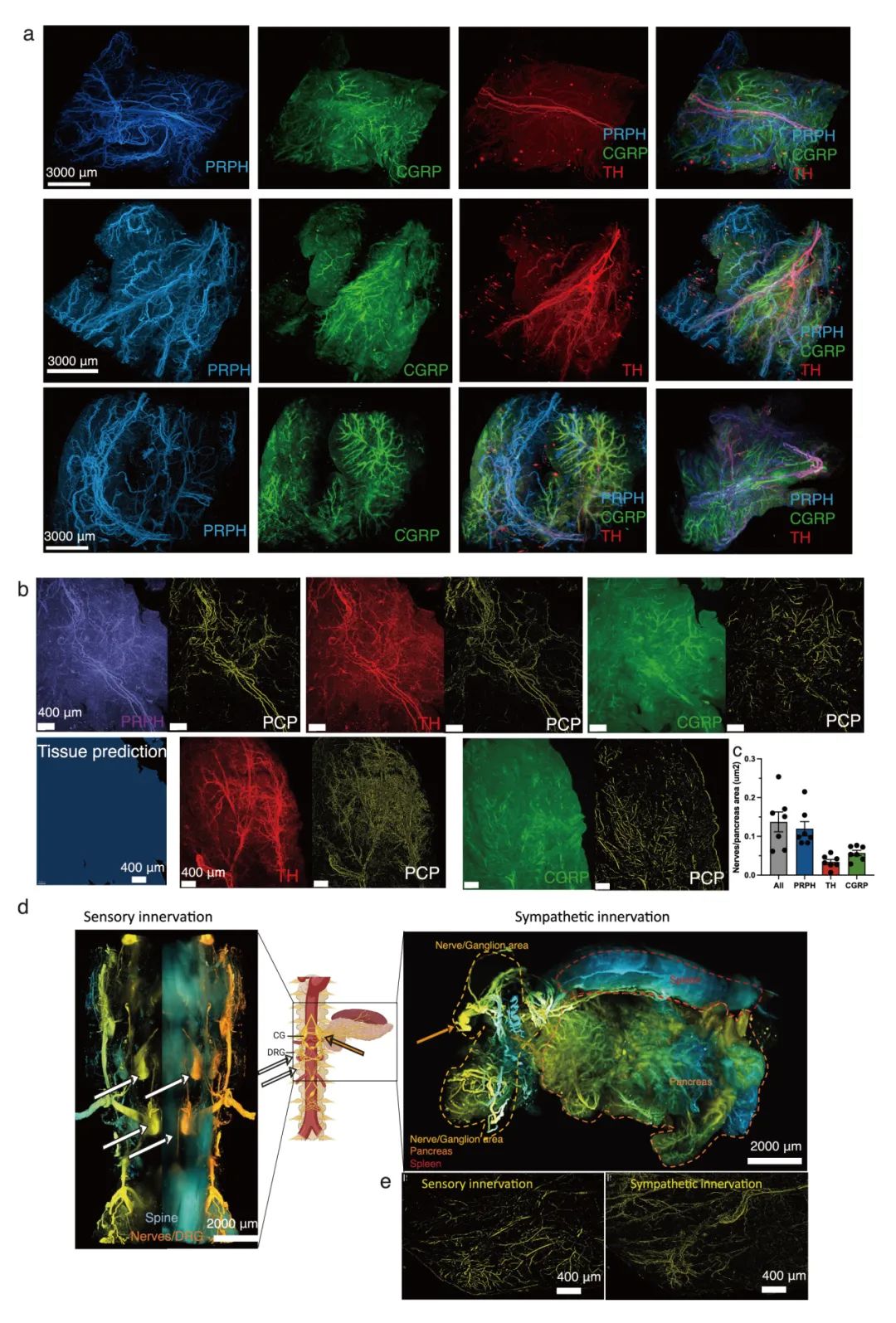
补充图1 胰腺神经支配的三维结构
✦
•
✦
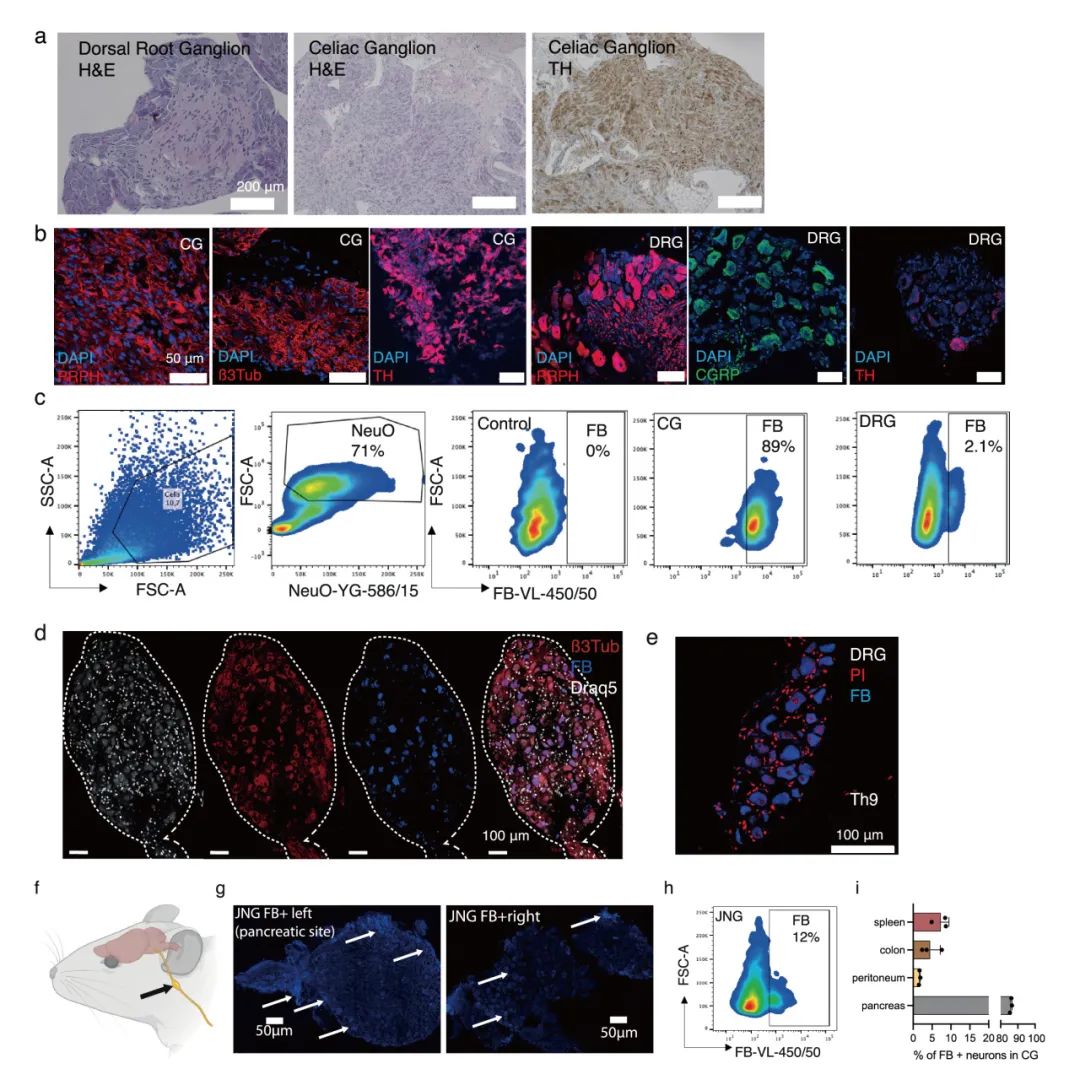
补充图2 Trace-n-Seq 标记的验证
✦
•
✦
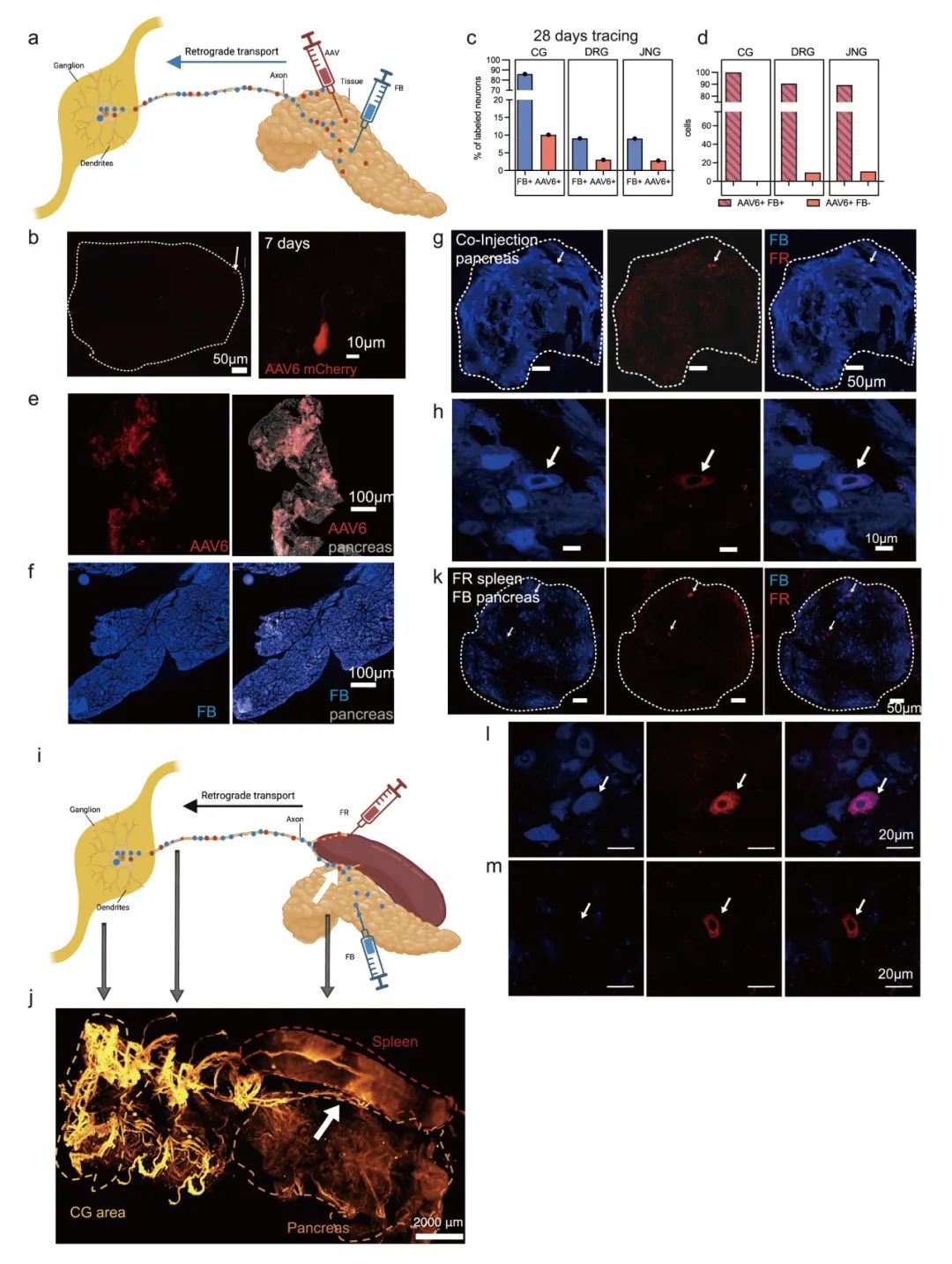
补充图3 逆行示踪效率比较
JARVIS
解析胰腺神经元异质性
通过Trace-n-Seq分析,作者共获得1384个胰腺神经元,包括:背根神经节(DRG):589个;腹腔神经节(CG):689个;颈静脉迷走神经节(JNG):106个。发现胰腺神经元分为两种主要交感神经亚型(CG1、CG2,去甲肾,上腺素能)和三种谷氨酸能的感觉神经亚型(NEFM、PEP、NPEP)。DRG神经元亚型(共17种)中,有12种可投射至胰腺,其中经典的伤害性感受神经元缺乏投射。CG神经元亚型分别表达Shox2 (CG1)、Socs2和Slit2 (CG2),其中CG2可能调节胰岛素分泌。通过多器官对比,揭示了神经元亚型分布的器官特异性(如腹膜富集伤害性神经元),并发现同一神经节神经元因靶器官不同呈现差异基因表达。Trace-n-Seq实现了对任意组织支配神经元的单细胞转录组分析,通过分子图谱验证并拓展了经典神经解剖学认知,例如腹膜较腹部上皮器官具有更强的伤害性神经支配,且CG中缺乏支配汗腺的胆碱能交感神经元。该技术为研究生理或病理状态下的器官神经支配提供了重要分子见解(图1,补充图4-6)。
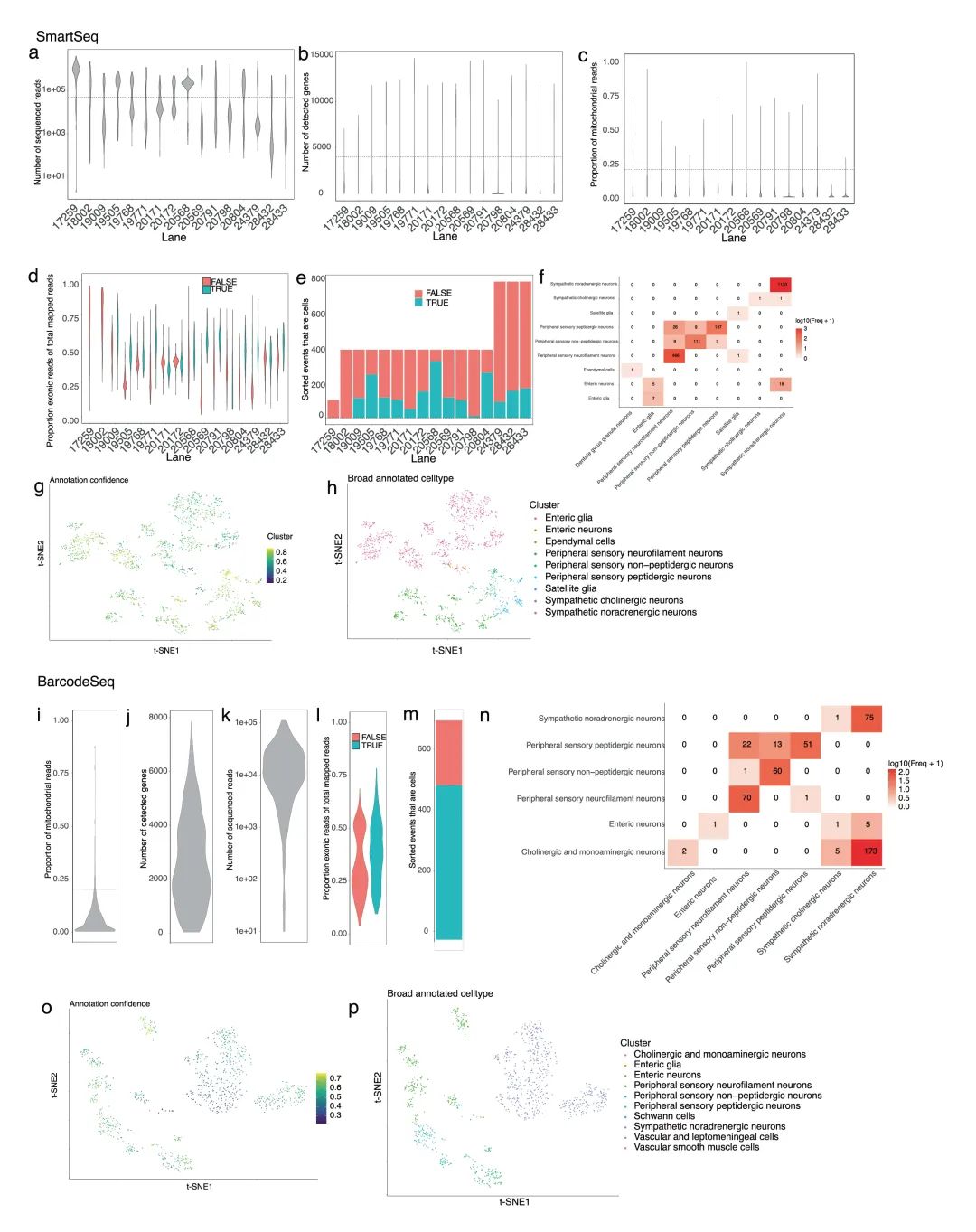
补充图4 对 Trace-n-Seq 生成的 scRNA-seq 数据进行质量控制
✦
•
✦
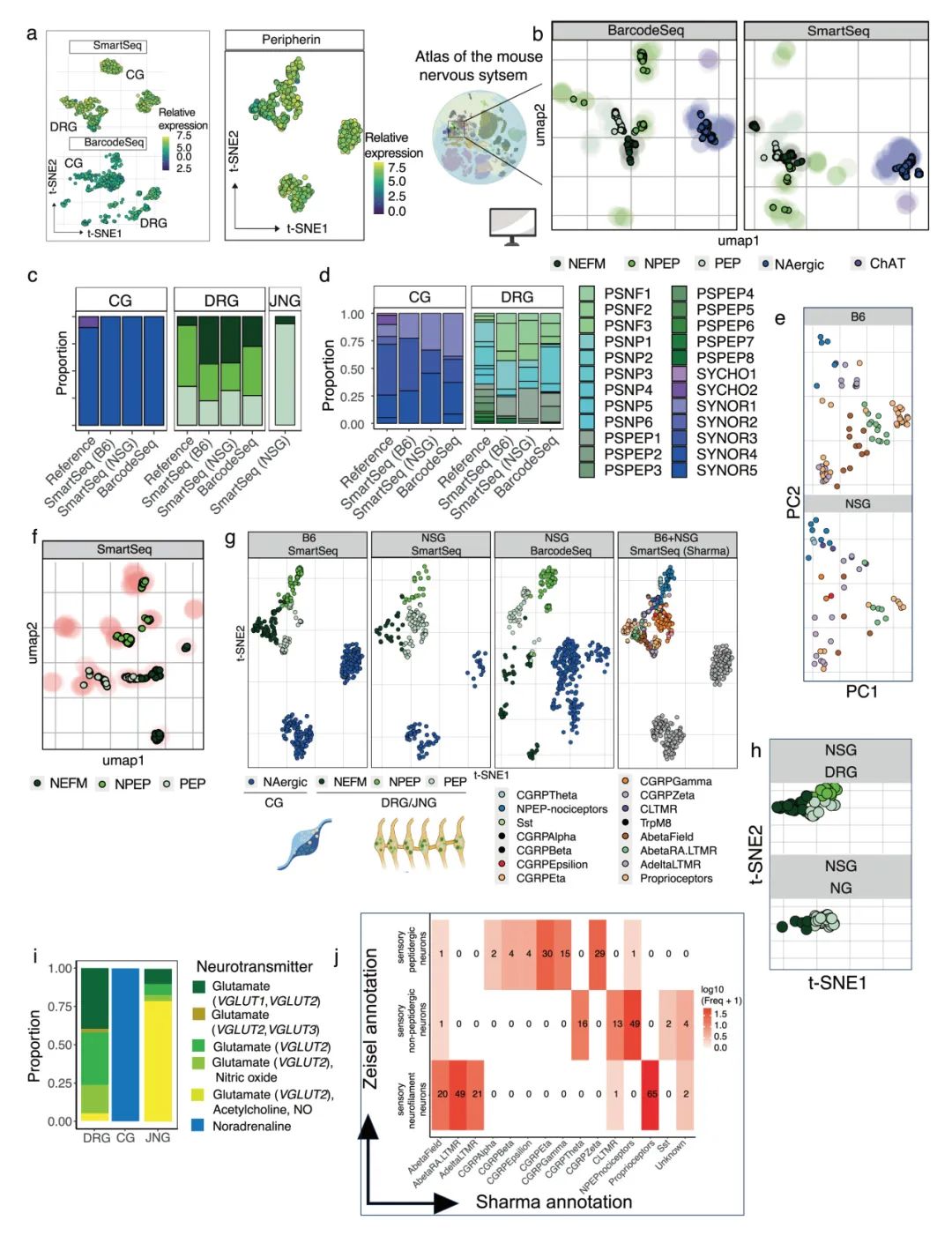
补充图5 基于图谱的 Trace-n-Seq 数据的细胞类型注释
✦
•
✦
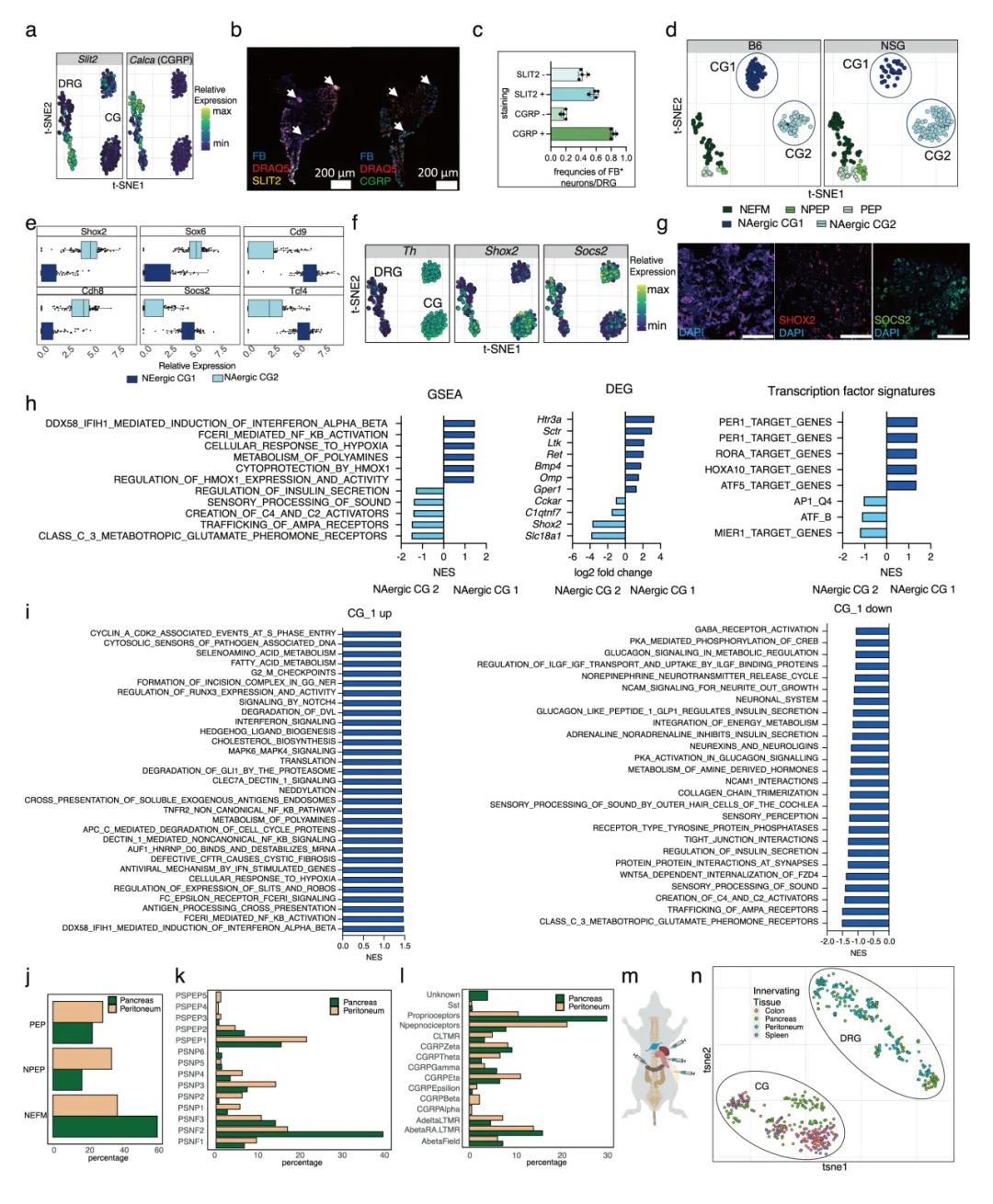
补充图6 外周神经节神经元亚型的鉴定
JARVIS
胰腺导管腺癌(PDAC)中的神经元异常支配
通过四种PDAC模型(包括两种人源原位PDX模型、KRAS-G12V转座子电转联合CRISPR-Cas9介导Tp53缺失的自发模型,以及KPC小鼠同种移植模型),采用3D光片荧光显微镜技术系统分析了肿瘤神经浸润特征。研究发现:伤害感受性(CGRP+)、交感(TH+)和副交感(vACHT+)神经元在肿瘤组织中呈现无序性轴突发芽,其末梢密集分布于非坏死区域,神经支配面积显著大于正常胰腺组织。通过逆行示踪实验证实,PDAC中的异常神经支配主要源于既有神经元轴突发芽增加(而非新生神经元产生),其中DRG-L1神经元增多可能与肿瘤生长对邻近神经的趋化作用有关。这些发现揭示了PDAC中神经异常支配的形态学特征及其形成机制(图2,补充图7-8)。
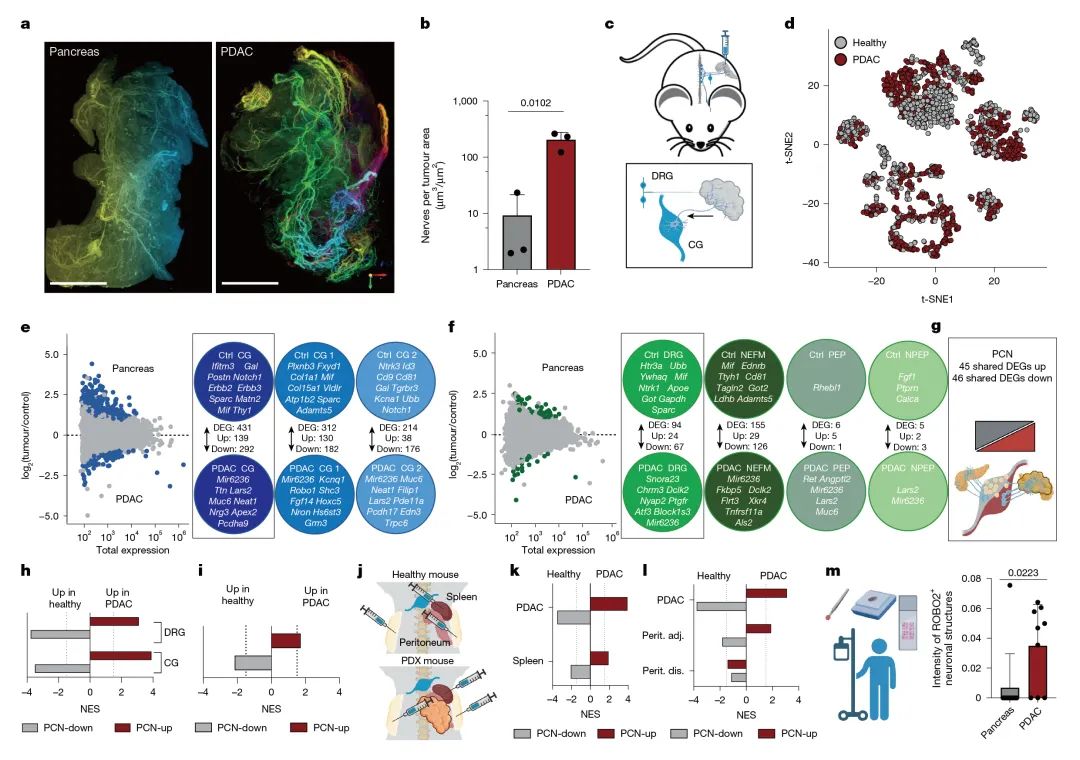
图2 PDAC 诱导肿瘤特异性神经元表达谱
✦
•
✦
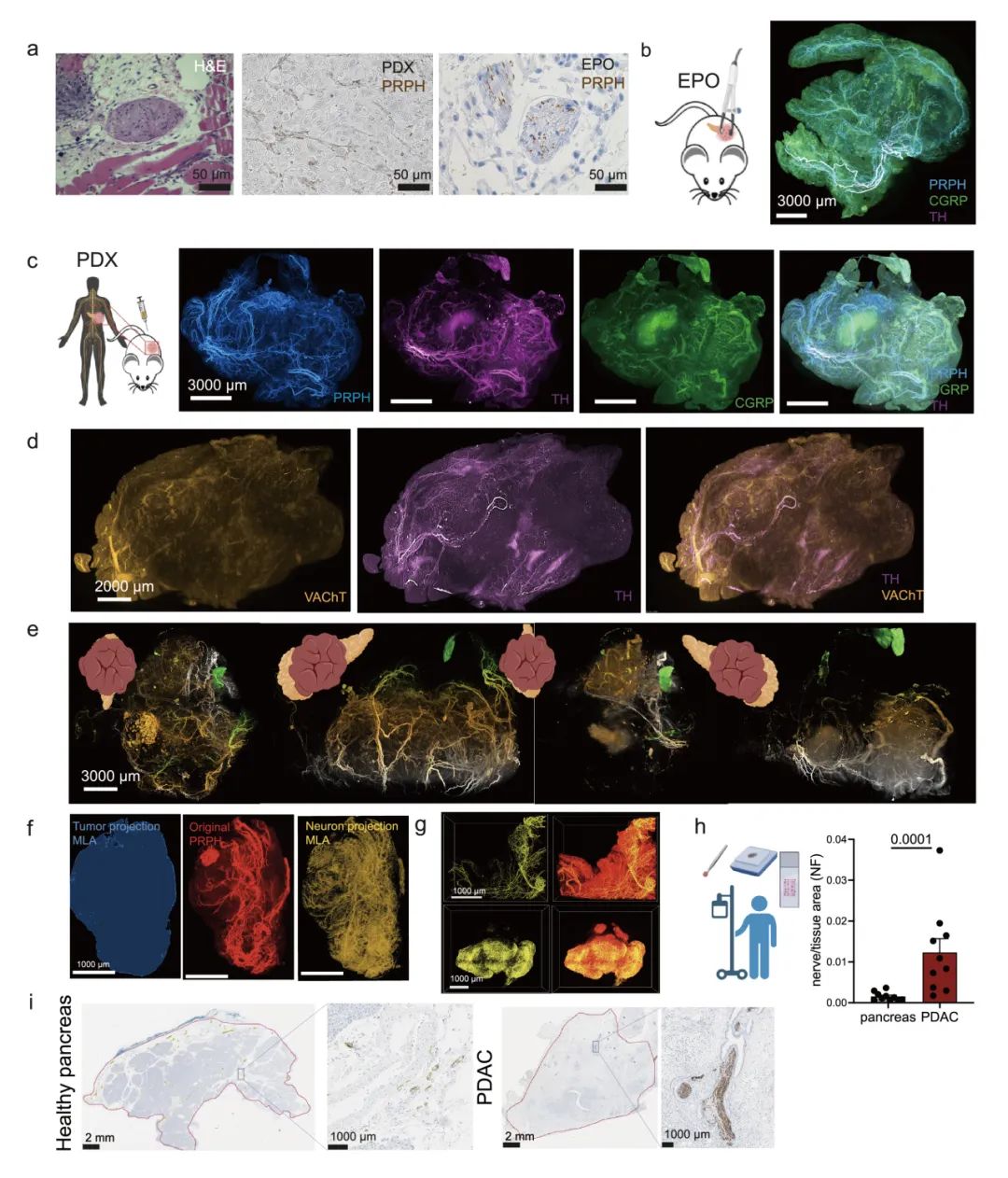
补充图7 PDAC 神经元浸润成像
JARVIS
PDAC诱导的神经元重编程
通过Trace-n-Seq技术系统揭示了PDAC对神经支配的重编程作用:比较分析显示PDAC相关神经元存在431个差异表达基因,表现为神经传递相关基因(如神经肽和受体)下调,而轴突导向因子(Robo1)和非编码RNA等上调;代谢通路(电子传递链等)普遍抑制,但神经发育程序(Hox/Meis1)和损伤修复相关通路(DNA修复等)激活。值得注意的是,不同神经元亚型对PDAC微环境的响应存在显著异质性 - NEFM神经元呈现155个基因改变,而肽能/非肽能神经元仅少量基因受影响。这些发现不仅阐明了PDAC通过特异性调控神经元转录组来重塑神经支配网络的分子机制,更为理解肿瘤-神经互作提供了单细胞水平的理论基础(图2,补充图8-9)。
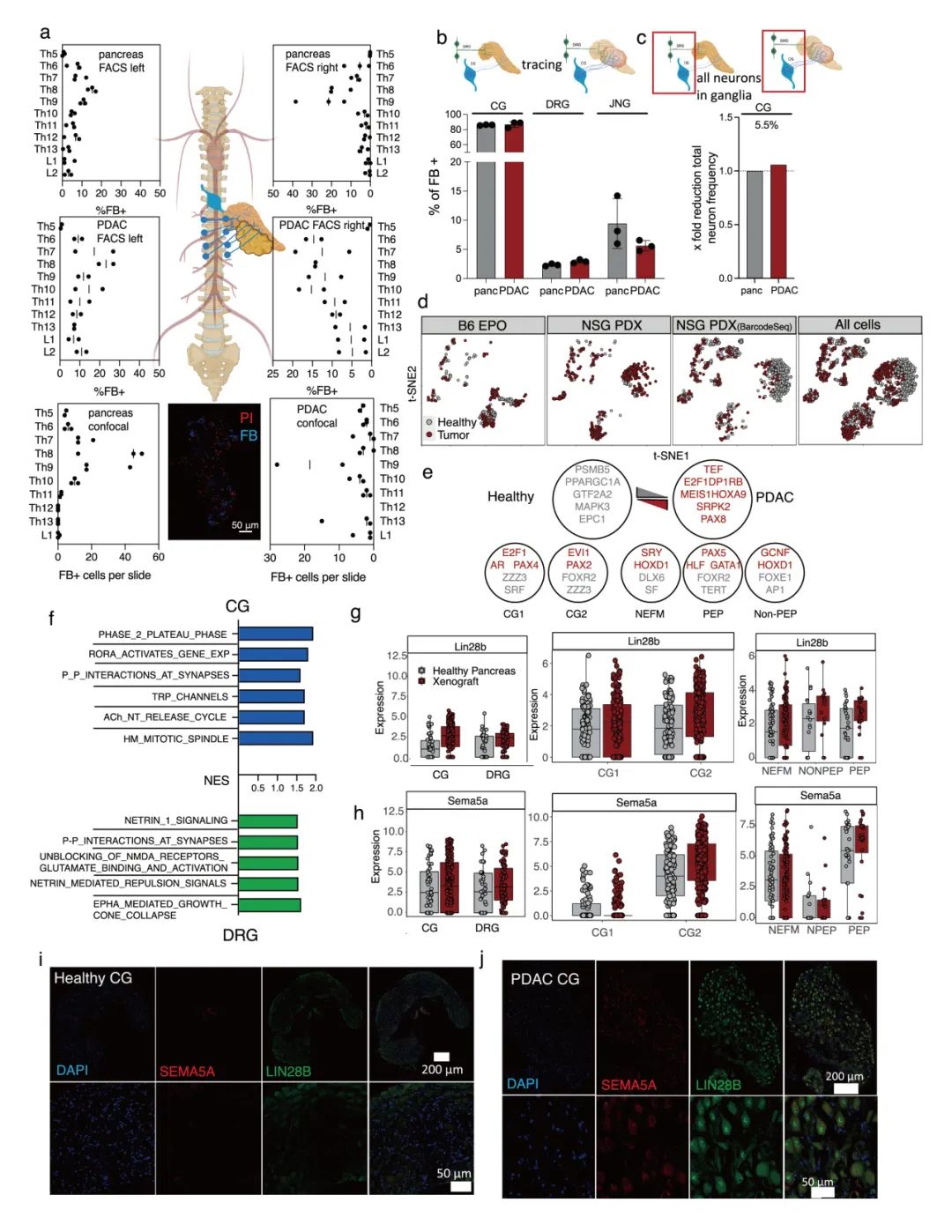
补充图8 PDAC 神经元的重编程
JARVIS
PDAC可诱导特异性神经特征
通过比较PDAC神经元与去神经支配或无菌性炎症的基因表达特征,发现PDAC诱导的神经元变化具有独特性,与炎症或损伤引发的反应显著不同。研究人员整合了多个神经元亚群的差异表达基因,构建了胰腺癌神经(PCN)特征谱(PCN-up和PCN-down),并在多种模型中验证了其准确性,证明该特征能有效区分PDAC相关神经元和健康神经元,尤其在NEFM和交感神经元中表现突出。这一发现揭示了PDAC对神经系统的特异性影响,为理解肿瘤-神经互作及开发潜在治疗策略提供了新方向(图2,补充图9-10)。
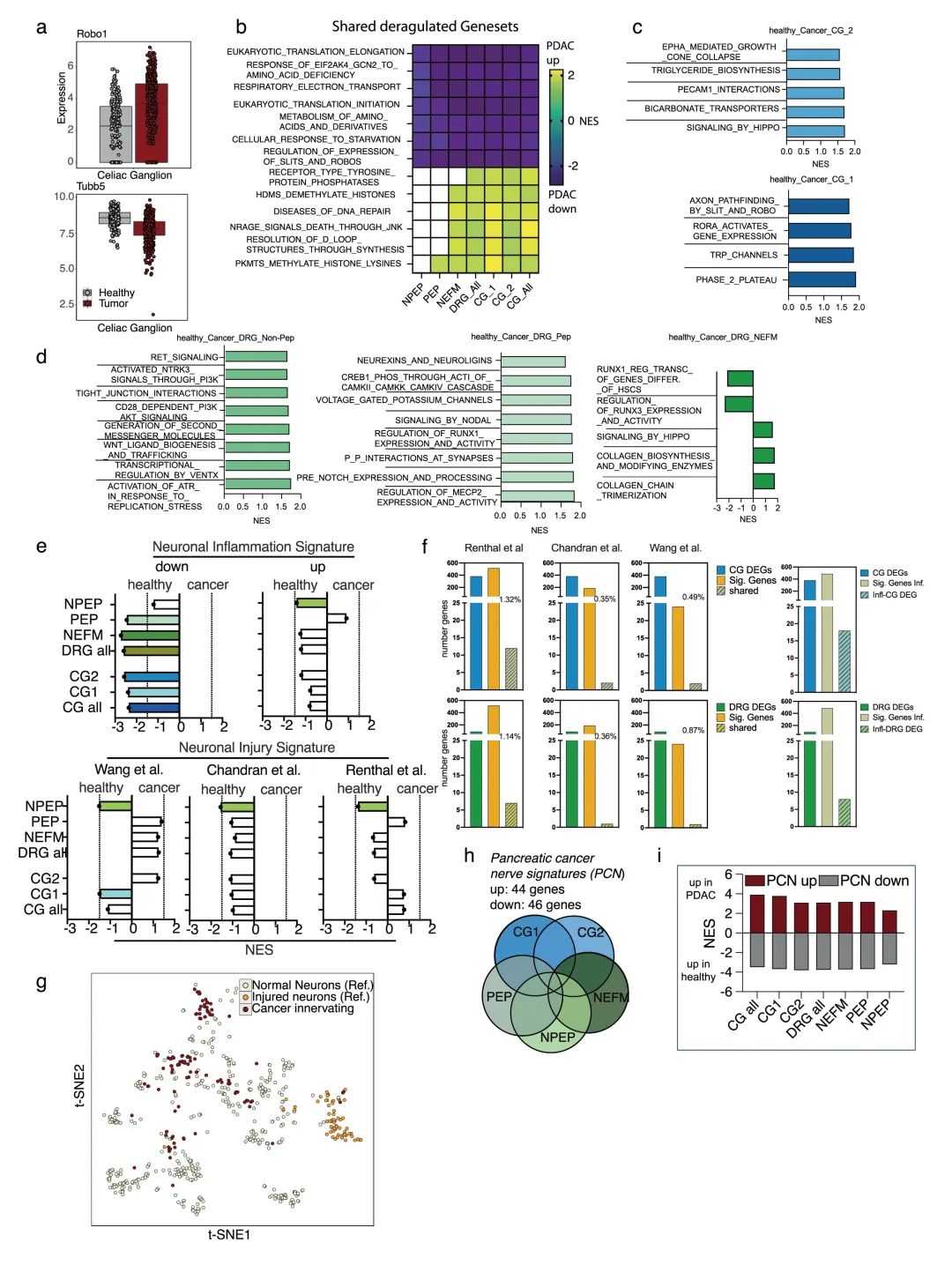
补充图9 PDAC神经元的特征性功能标记
✦
•
✦
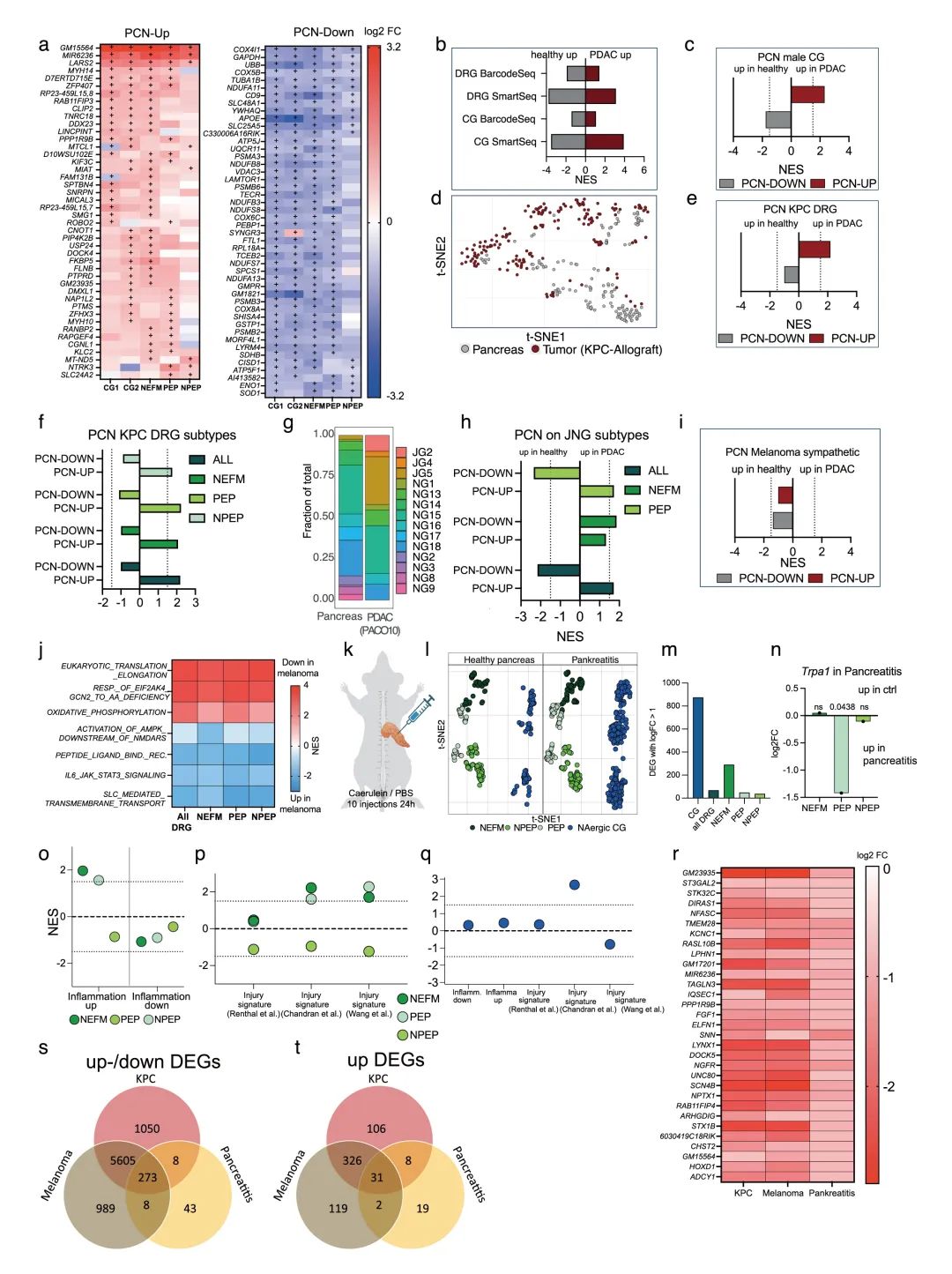
补充图10 癌症与胰腺炎中的神经元表达变化
JARVIS
PCN特征谱的呈现与肿瘤距离相关
PDAC诱导的PCN神经特征谱具有显著的空间依赖性,仅在肿瘤邻近部位(如脾脏和腹膜支配的DRG神经元)中富集PCN-up基因,而远端神经元(如盆腔DRG)未受影响。研究揭示了PDAC通过局部神经重塑可能影响脾脏免疫微环境,并证实人类PDAC神经元中ROBO2基因显著上调,这些发现为理解肿瘤-神经-免疫互作提供了新视角,并为开发针对肿瘤微环境中神经重塑的靶向策略奠定了分子基础(图2)。
JARVIS
胰腺内肿瘤选择性招募NEFM神经元
通过建立PDAC、胰腺内黑色素瘤移植瘤以及胰腺炎等多种动物模型,结合Trace-n-Seq技术和三维成像技术,系统揭示了肿瘤微环境对神经元亚型的选择性调控机制。研究发现,不同于炎症性病变,胰腺内肿瘤(包括PDAC和黑色素瘤)会特异性激活NGF等信号通路,显著增加NEFM亚型神经元(Slit2+)的浸润,同时抑制疼痛相关PEP/NPEP神经元(CGRP+)的分布。这种神经元亚型重编程表现为:1)分子水平上NEFM标志物Slit2显著上调,而疼痛介质CGRP表达降低;2)细胞水平上SLIT2+神经元比例增加,CGRP+神经元减少;3)通路水平上黑色素瘤中IL-6信号通路和氨基酸转运相关基因特异性激活。值得注意的是,这种神经重塑模式在六种独立的肿瘤模型中高度一致,且在人类PDAC组织中得到验证,但在胰腺炎模型中完全缺失(后者主要诱导Trpa1等疼痛感受器上调)。该发现不仅阐明了肿瘤微环境对特定神经元亚型的主动招募机制,更揭示了肿瘤与神经系统互作的特异性分子基础,为开发基于神经-肿瘤互作的精准治疗策略(如靶向NEFM神经元或Slit2信号通路)提供了重要的理论依据和潜在靶点(图3,补充图10-11)。
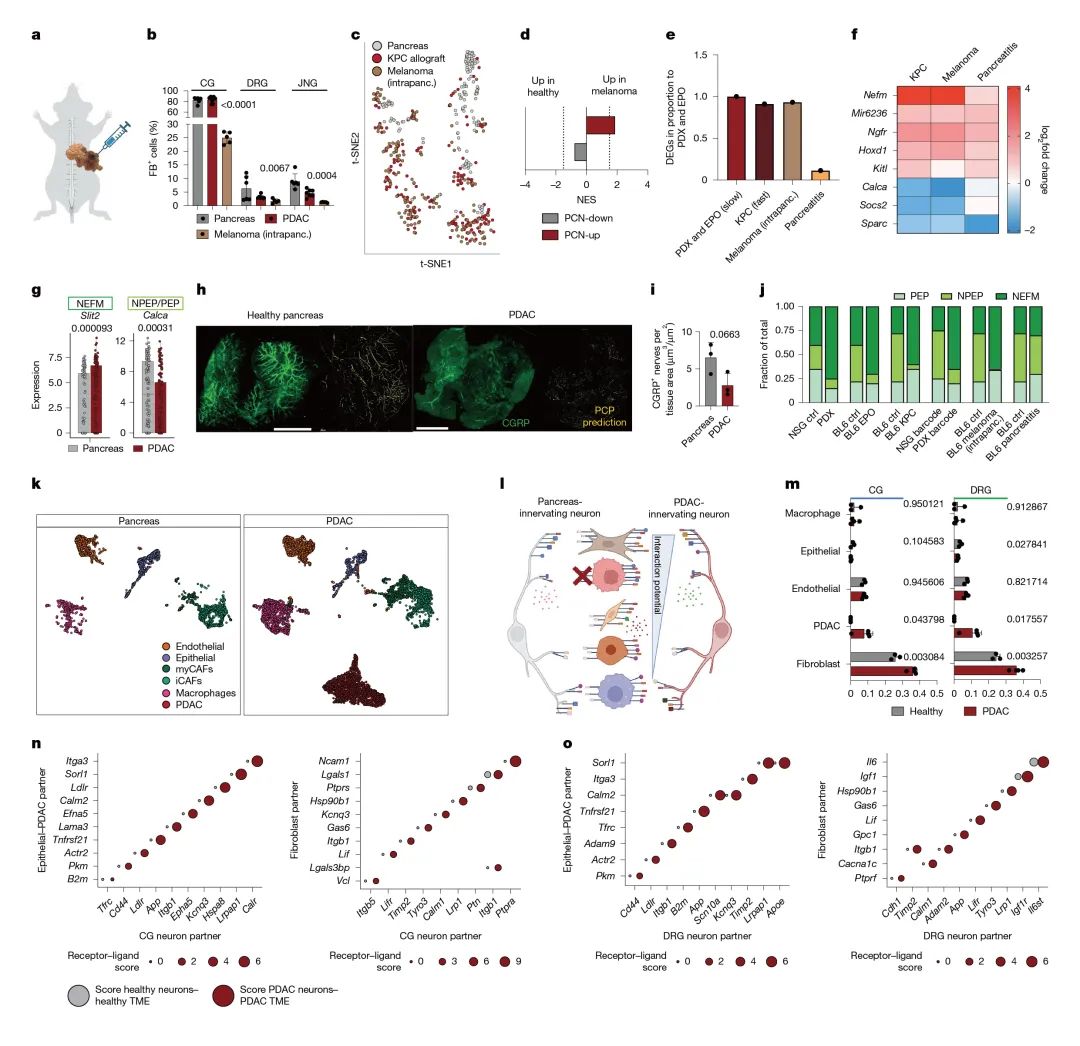
图3 胰腺导管腺癌(PDAC)可重塑神经元互作网络并选择性招募特定亚型神经元至肿瘤微环境(TME)
✦
•
✦
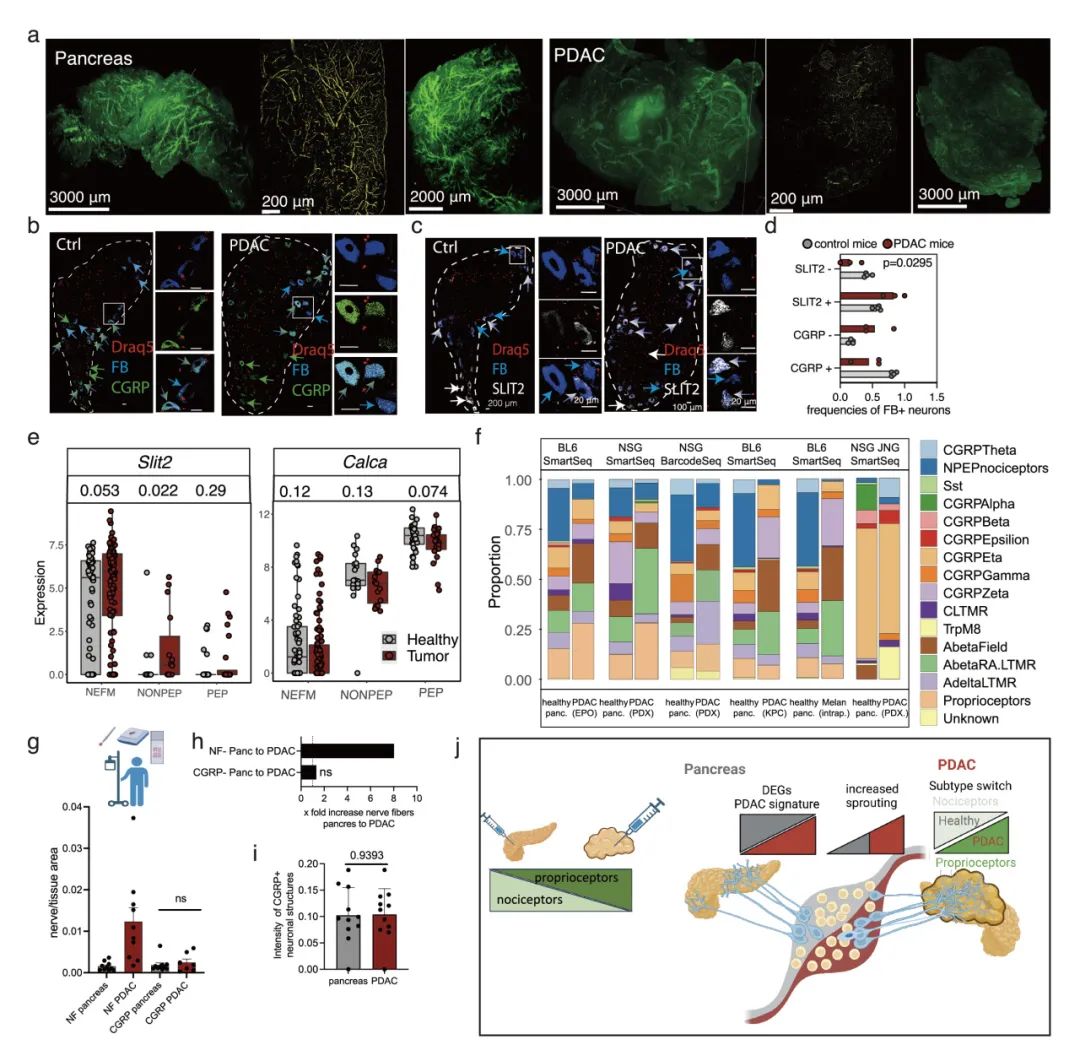
补充图11 表达SLIT2的NEFM神经元优先支配肿瘤组织
JARVIS
PDAC神经支配神经元的互作组
通过整合单细胞转录组测序和生物信息学分析,系统揭示了神经元在PDAC微环境中的关键调控网络。研究发现PDAC中神经元与肿瘤微环境细胞(特别是癌症相关成纤维细胞CAFs)的互作显著增强,CAFs与神经元的相互作用强度明显高于正常成纤维细胞,提示神经元可能通过CAFs间接调控肿瘤进展。研究鉴定出多个特异性增强的配体-受体对,包括PDAC细胞来源的Efna5与颈上神经节神经元Epha5的相互作用、CAF/内皮细胞分泌的Gas6与背根神经节神经元Tyro3的结合,以及IL6-IL6st等信号通路。这些分子互作可能共同构成了神经元调控PDAC发展的关键网络。体外功能实验证实,神经元或其条件培养基能显著促进PDAC细胞、成纤维细胞和CAFs的增殖(增幅达30-50%),其中颈上神经节神经元的作用最为显著。机制研究表明,神经元通过上调MYC靶基因和G2/M检查点相关通路来驱动细胞增殖。然而值得注意的是,体外实验仅能部分复现体内观察到的分子变化,这一差异凸显了肿瘤微环境复杂性的重要性,也提示神经元对PDAC的调控可能涉及更复杂的多细胞网络和微环境因素(图3,补充图12-13)。
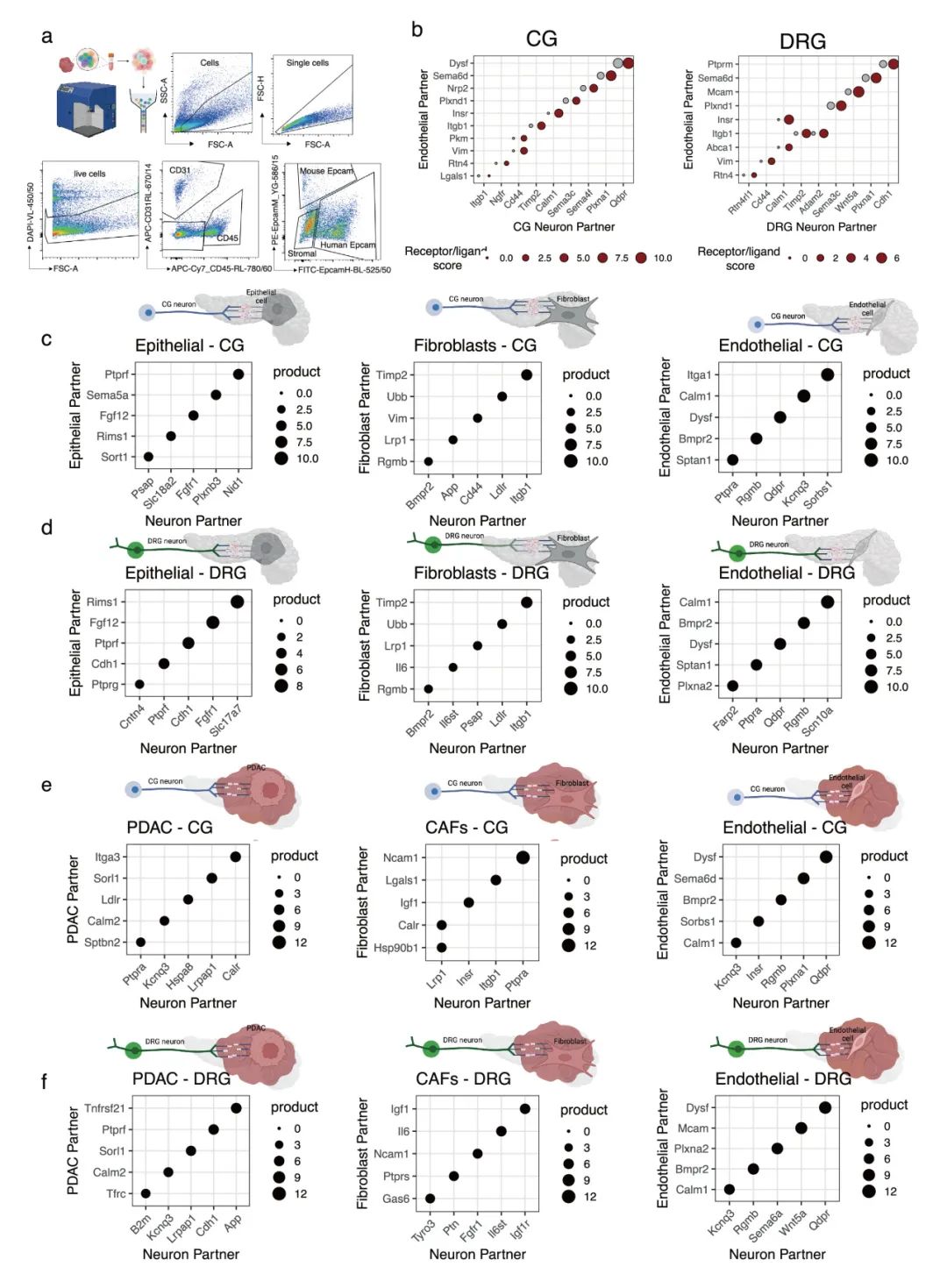
补充图12 PDAC及其肿瘤微环境中过表达的受体-配体对
✦
•
✦
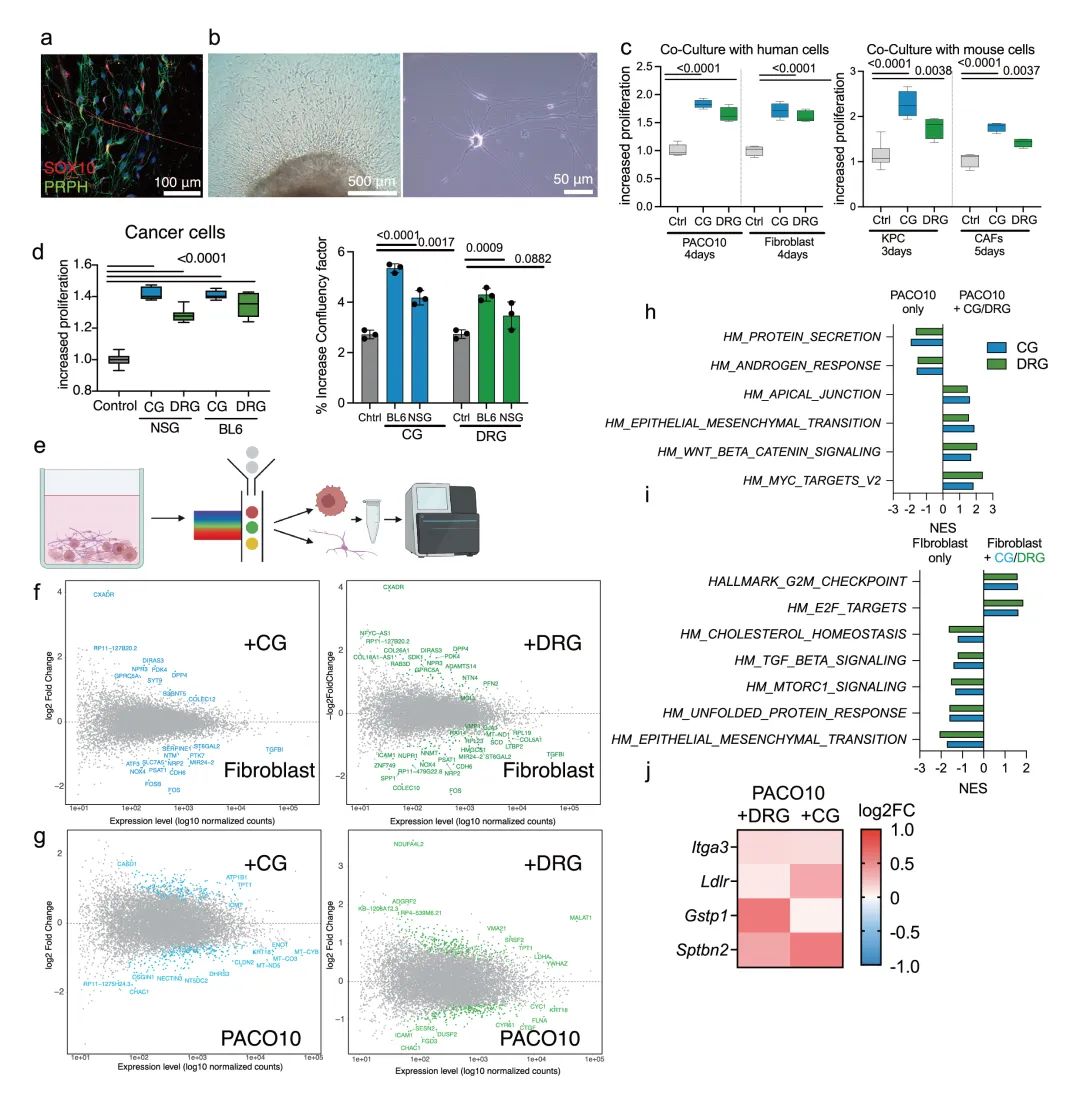
补充图13 体外神经元共培养促进PDAC及CAF增殖
JARVIS
去神经支配增敏PDAC对免疫治疗的响应
通过系统性去神经化干预(包括手术切除腹腔神经节和6-OHDA化学去神经)揭示了交感神经系统在PDAC发生发展中的关键调控作用。研究结果显示,去神经化处理可显著抑制肿瘤生长,使移植瘤重量下降达3倍,且这一效果在肿瘤形成3-4周后的晚期干预中仍然显著。分子机制研究表明,去神经化通过多重途径重塑肿瘤微环境:一方面下调肿瘤细胞和癌症相关成纤维细胞(CAFs)中与增殖和能量代谢相关的关键通路(如氧化磷酸化),另一方面显著上调炎症相关基因(包括Tnf、Il1b等)的表达,促使CAFs从促纤维化表型向促炎症表型转化。这种微环境的重塑进一步增强了免疫细胞的浸润和活化,在免疫健全的动物模型中,去神经化联合PD-1抑制剂治疗显示出显著的协同效应,使肿瘤体积缩小5.7倍,突破了传统免疫治疗对"冷肿瘤"PDAC疗效有限的瓶颈。这些发现与其他癌症中靶向神经元可增强免疫疗法的报道一致,可能为原本免疫"冷"性的PDAC开辟新的治疗选择(图4-5,补充图14)。
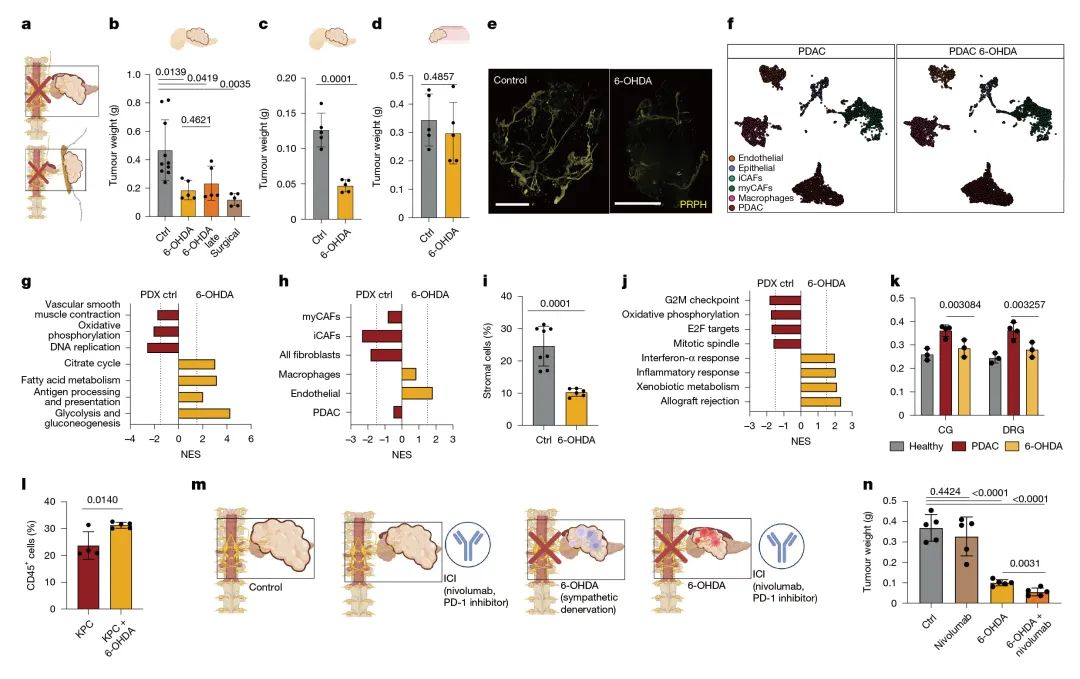
图4 去神经化治疗延缓胰腺导管腺癌(PDAC)进展并通过诱导癌症相关成纤维细胞(CAFs)的促炎性转化增强PDAC对免疫检查点抑制剂(ICIs)的敏感性
✦
•
✦
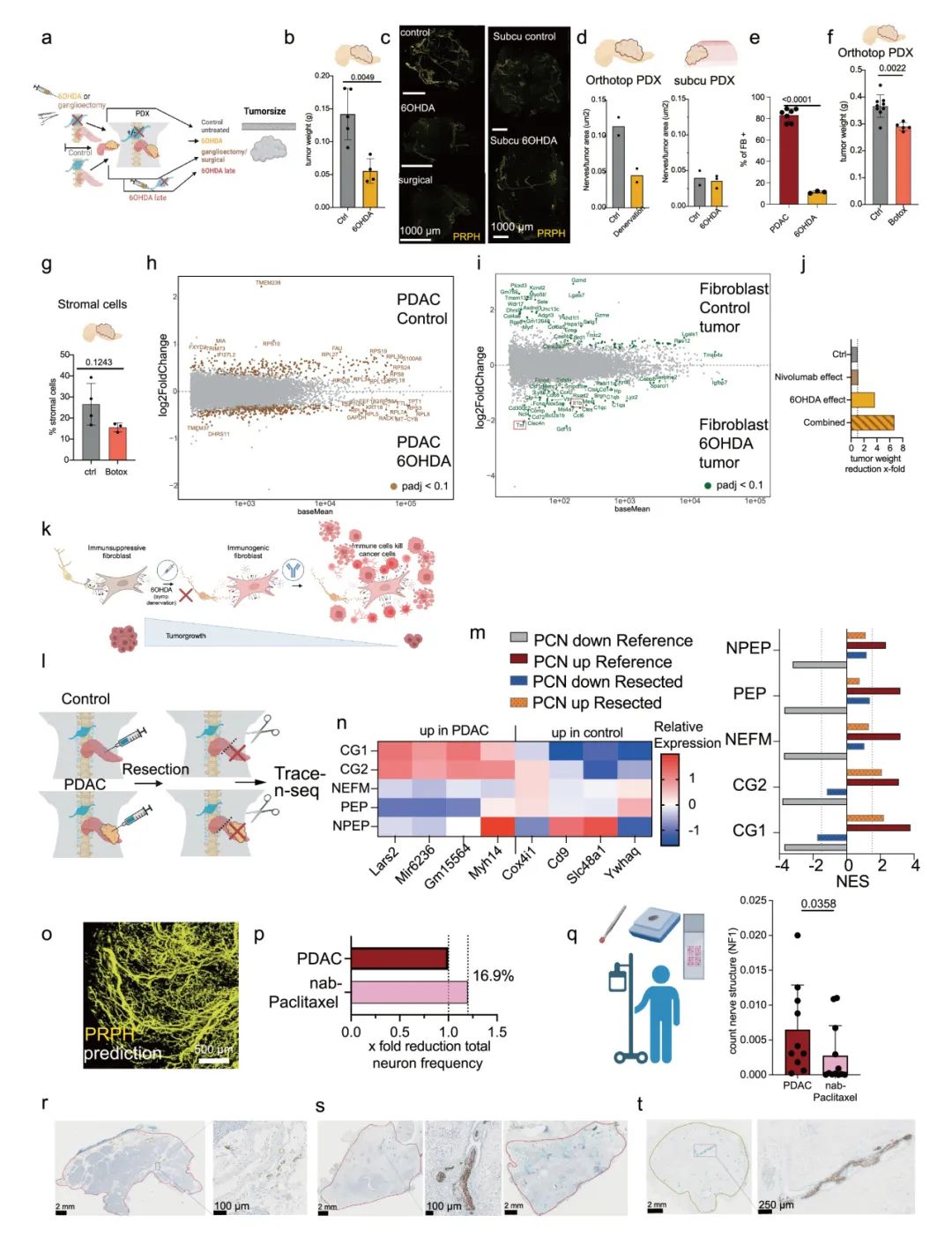
补充图14 去神经化治疗显著抑制胰腺导管腺癌(PDAC)的肿瘤生长和局部复发
JARVIS
CG(腹腔神经节)重编程促进局部复发
局部复发是胰腺导管腺癌(PDAC)切除术后的主要临床难题。为探究神经元在此过程中的作用,作者通过动物模型证实,胰腺导管腺癌(PDAC)术后局部复发与交感神经重编程密切相关。实验显示,既往肿瘤宿主的二次PDAC生长速度加快2.5倍,而6-OHDA介导的去神经化可有效阻断这一过程。分子机制上,即使肿瘤切除4周后,腹腔神经节(CG)仍持续过表达Mir6236等基因,维持"癌症神经状态"。这些发现揭示了神经元通过形成预激活肿瘤微环境促进PDAC复发的关键作用,为临床预防术后复发提供了新的治疗靶点(图5)。
JARVIS
Nab-紫杉醇通过去神经作用抑制PDAC生长
白蛋白结合型紫杉醇(Nab-paclitaxel)治疗胰腺导管腺癌(PDAC)的双重作用机制:除通过抑制微管功能阻滞肿瘤细胞增殖外,该药物还能特异性清除肿瘤微环境中的感觉神经纤维。通过整合Trace-n-Seq测序和3D光片荧光显微技术,我们发现Nab-paclitaxel治疗可显著减少肿瘤内轴突发芽(降幅达62%),经过4个治疗周期后,感觉神经元标记率呈现剂量依赖性降低(DRG神经元减少9.8倍),同时选择性保留酪氨酸羟化酶(TH+)交感神经元。与FOLFIRINOX方案(含奥沙利铂)的单纯细胞毒性作用形成鲜明对比,临床组织学分析进一步证实紫杉醇组患者神经/肿瘤比显著下降。这些数据证明,Nab-paclitaxel(而非奥沙利铂)主要通过靶向肿瘤内感觉神经元的发芽来发挥抗肿瘤效应,这为Nab-paclitaxel的抗肿瘤作用提供了新的机制解释(图5,补充图14-15)。
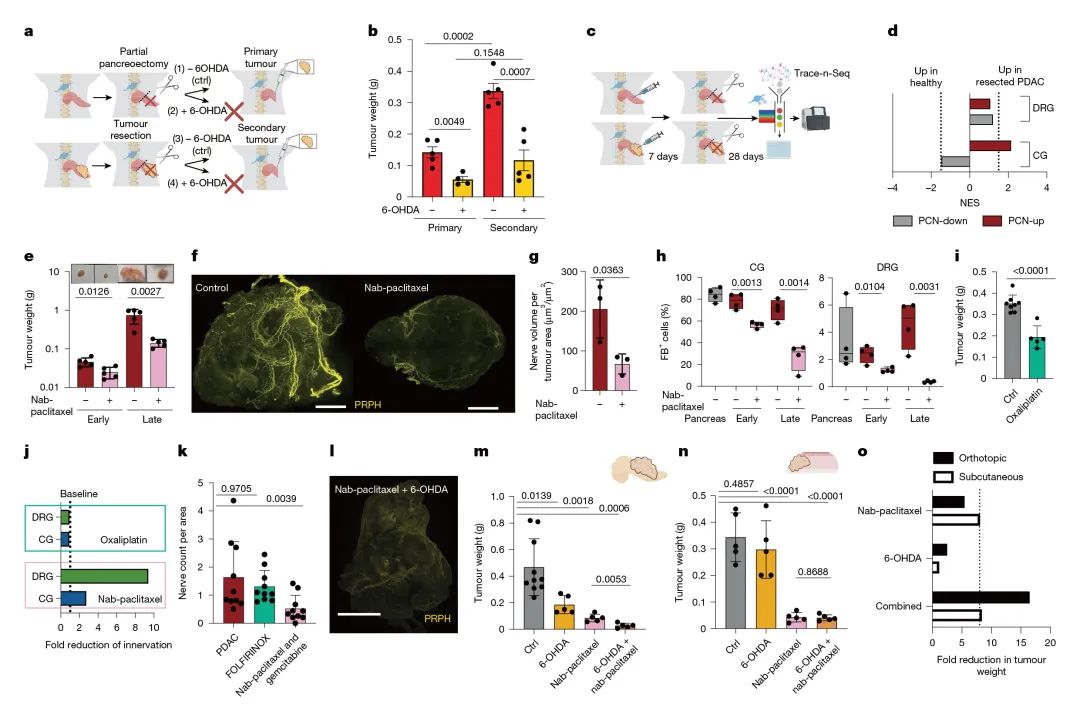
图5 白蛋白结合型紫杉醇通过清除肿瘤浸润神经元抑制肿瘤生长
JARVIS
联合去神经治疗破坏PDAC进展
通过Trace-n-Seq技术对健康胰腺、未经治疗的PDX模型、奥沙利铂和白蛋白结合型紫杉醇治疗2或4个周期后的PDX肿瘤进行分析首次证实,去神经化治疗与紫杉醇类化疗药物在胰腺导管腺癌(PDAC)治疗中具有显著的协同效应。实验数据显示,交感神经化学消融(6-OHDA)联合白蛋白结合型紫杉醇治疗可使肿瘤体积最大缩减16.5倍,远超单药治疗效果(分别为2.5倍和5.5倍)。这种协同作用源于对肿瘤微环境中不同神经成分的精准靶向:6-OHDA选择性清除交感神经纤维,而紫杉醇则主要作用于感觉神经元,两者互补形成全面的神经阻断效应。值得注意的是,虽然紫杉醇单药治疗能显著减少62%的肿瘤内轴突发芽,但残余神经元仍保持促瘤转录特征,这解释了联合治疗的必要性。白蛋白结合型紫杉醇(以及程度较轻的奥沙利铂)的抗PDAC效果可通过交感神经消融显著增强。这一联合策略值得在前瞻性临床试验中进一步评估。(图5,补充图15)
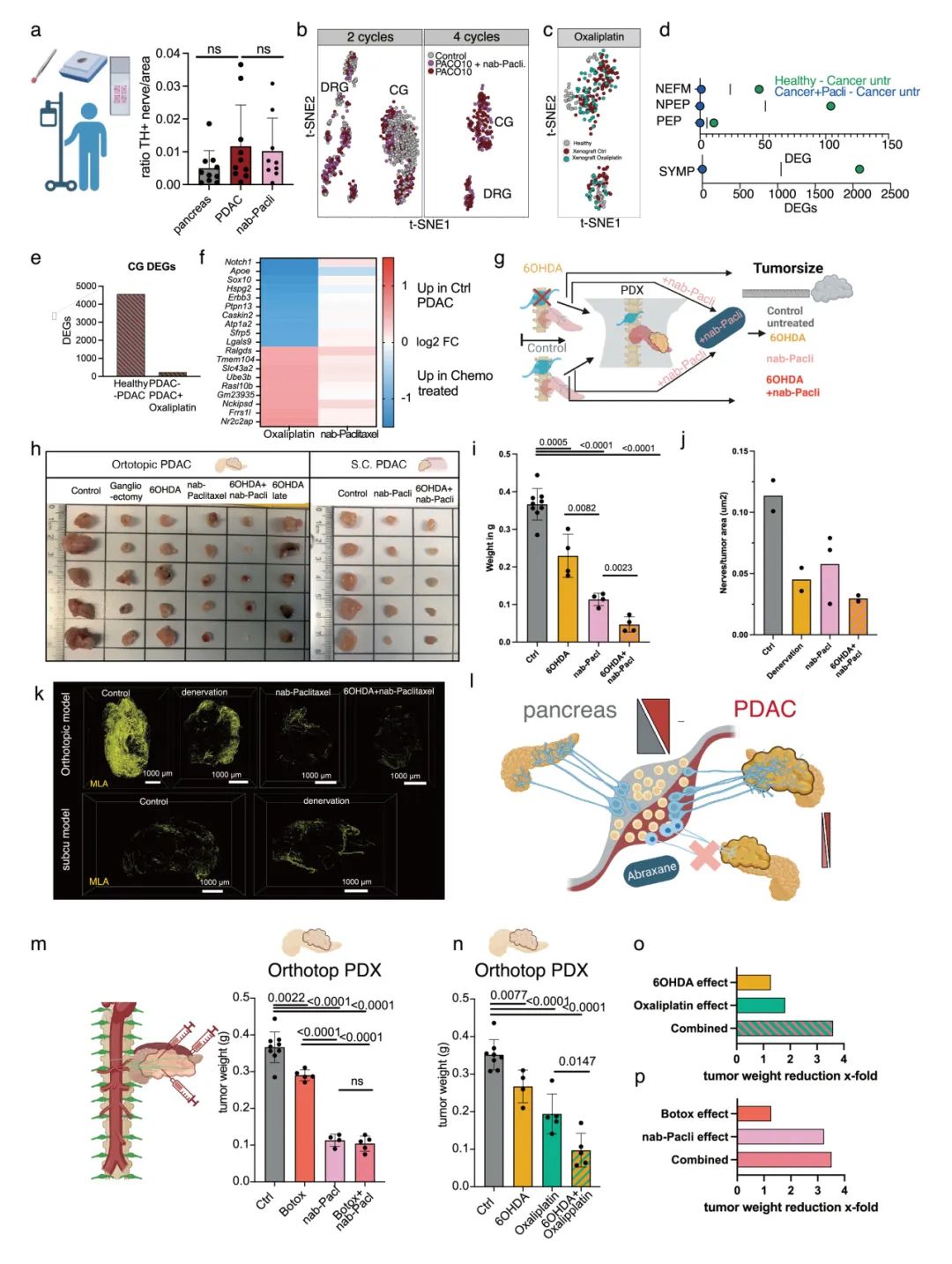
补充图15 去神经化治疗与紫杉类化疗在PDAC中产生协同效应
总结
Trace-n-Seq技术实现了动物模型中对支配器官或肿瘤的神经元进行单细胞精度的鉴定与分子解析。研究发现,胰腺导管腺癌(PDAC)会重编程神经元,诱导NEFM亚型感觉神经异常增生,并通过神经元-肿瘤细胞-CAFs互作网络促进癌症进展。肿瘤切除后持续存在的特定神经特征可能促进复发,而神经去除可激活CAFs并增强免疫治疗效果。研究揭示白蛋白紫杉醇具有抑制神经浸润的新机制,联合去神经治疗可协同抑制PDAC生长,凸显了靶向癌症-神经互作的治疗潜力。该技术为神经元相关肿瘤治疗靶点发现提供了新工具。