佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Nat Neurosci丨小胶质细胞在癫痫疾病中的神经调控机制
819 人阅读发布时间:2025-06-17 09:20
当中枢神经系统遇到感染、创伤等外部压力源时,大脑会进入应激状态,神经元网络通常会表现出过度兴奋并伴有突触重组。神经元过度兴奋是各种神经系统疾病的标志,包括阿尔茨海默病AD、自闭症谱系障碍、精神分裂症、结节性硬化症和癫痫。谷氨酸能兴奋性和GABA能抑制性突触传递(E/I平衡)之间的不平衡被认为是一个关键机制;然而,确切的分子机制仍不清楚。近年来,神经元-小胶质细胞调节已成为神经元兴奋性稳态的关键调节因子。例如,小胶质细胞在早期发育过程中感知神经元活动并主动修剪未成熟的突触过程,目前尚不清楚抑制性神经元是否能直接调节小胶质细胞活性以及小胶质细胞如何调节抑制性神经元功能。

2025年5月27日,南京大学闫超教授、苏州大学丛启飞教授、南京鼓楼医院神经外科刘翔宇主任及浙江大学李新建教授团队在Nature Neuroscience在线发表题为《GABA-dependent microglial elimination of inhibitory synapses underlies neuronal hyperexcitability in epilepsy》的研究成果,系统揭示了癫痫形成中,小胶质细胞通过选择性“修剪”抑制性突触,引起兴奋/抑制失衡,进而促进癫痫疾病进展的分子机制。
1、GABA 触发小胶质细胞活化和选择性抑制性突触丢失
为了研究病理条件下的抑制性神经元-小胶质细胞相互作用,作者使用了TLE的红藻氨酸KA小鼠模型,KA充当红藻氨酸受体的兴奋性毒性激动剂,KA注射后可以诱导癫痫持续状态。小胶质细胞作为驻留在CNS的免疫细胞,不断监控大脑微环境并对环境变化做出快速反应,作者使用iGABASnFR荧光探针,观察到KA注射后引起的全身性癫痫发作期间GABA短暂增加,表明GABA水平与癫痫发作的严重程度相关,这表明抑制性神经元是KA诱导的神经元兴奋后GABA释放的主要来源(图1)。
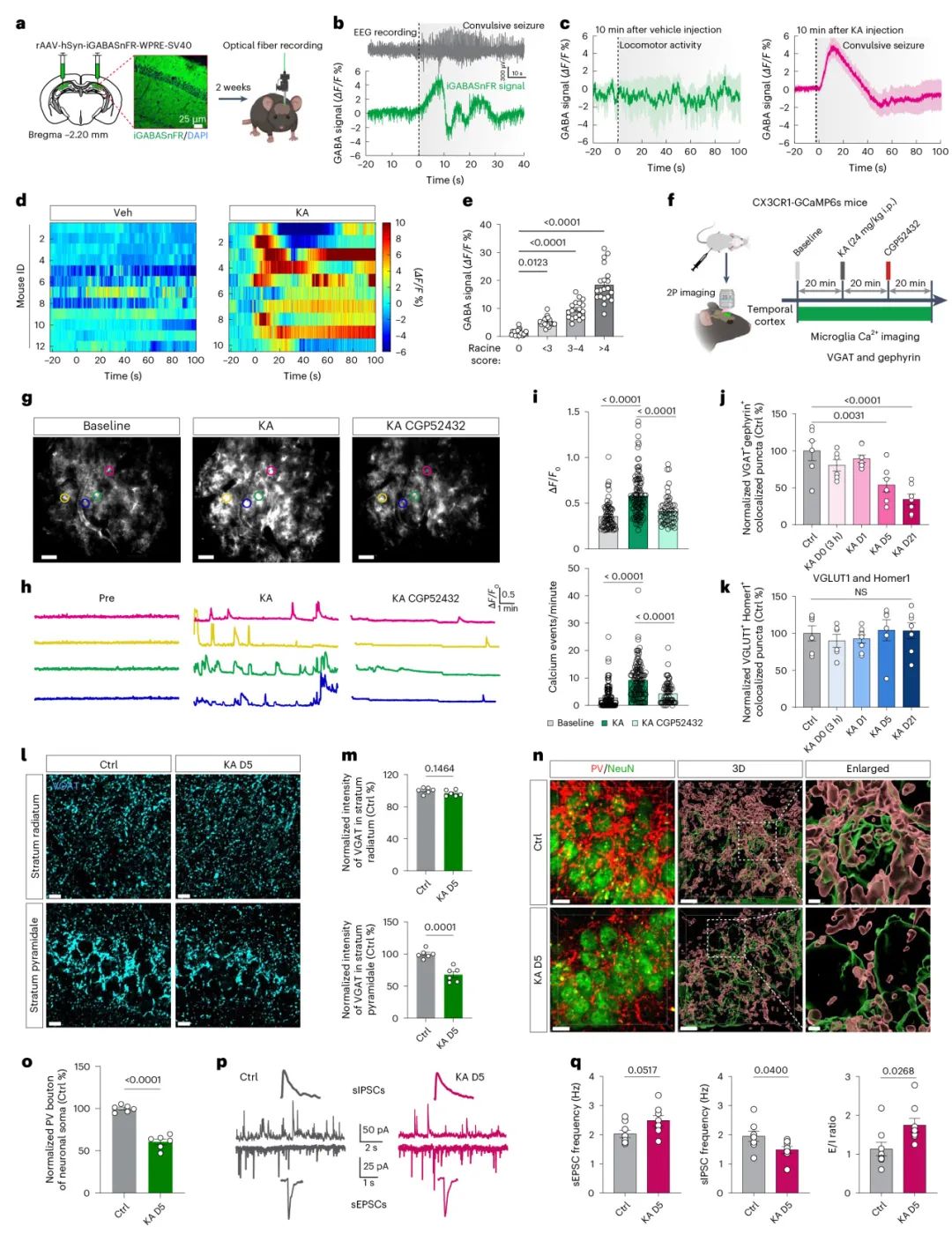
图1 GABA介导的小胶质细胞激活与KA刺激后的选择性抑制性突触丢失有关
接下来,作者通过海马体内单光子钙成像和CX3CR1-GCaMP6s小鼠颞叶皮层中的双光子钙成像监测小胶质细胞钙活性,研究小胶质细胞是否响应神经元兴奋而被激活。KA给药显著增加了两个核团的小胶质细胞钙信号,这种激活可以被随后腹腔注射的GABAB受体拮抗剂CGP52432抑制,这表明GABA能信号传导在小胶质细胞反应中发挥重要作用。接下来,作者评估了活化的小胶质细胞对突触结构和功能的影响。免疫荧光染色显示 VGAT+gephyrin+抑制性突触从D5开始丢失,VGLUT2+Homer1+兴奋性突触略有增加,表明选择性抑制性突触丢失在KA模型中是早期事件。且这种损失仅限于锥体层。在锥体神经元胞体上形成抑制性突触的小白蛋白PV能中间神经元受到主要影响。作者使用 PV-mCherry、VIP-mCherry和SST-mCherry小鼠来评估锥体层的突触前变化。只有PV能,而不是VIP / SST能神经元在D5显示出显著减少。接下来,作者使用全细胞膜片钳记录了KA刺激小鼠海马体中的突触传递。在D5观察到锥体细胞中自发性抑制性突触后电流sIPSC和微小抑制性突触后电流mIPSC的频率显著降低,同时伴随自发性兴奋性突触后电流sEPSC和微小兴奋性突触后电流的轻微增加。这些结果表明,抑制性神经元衍生的GABA触发小胶质细胞激活和选择性抑制性突触丢失,代表了在TLE中驱动神经元过度兴奋的早期致病事件(图2)。
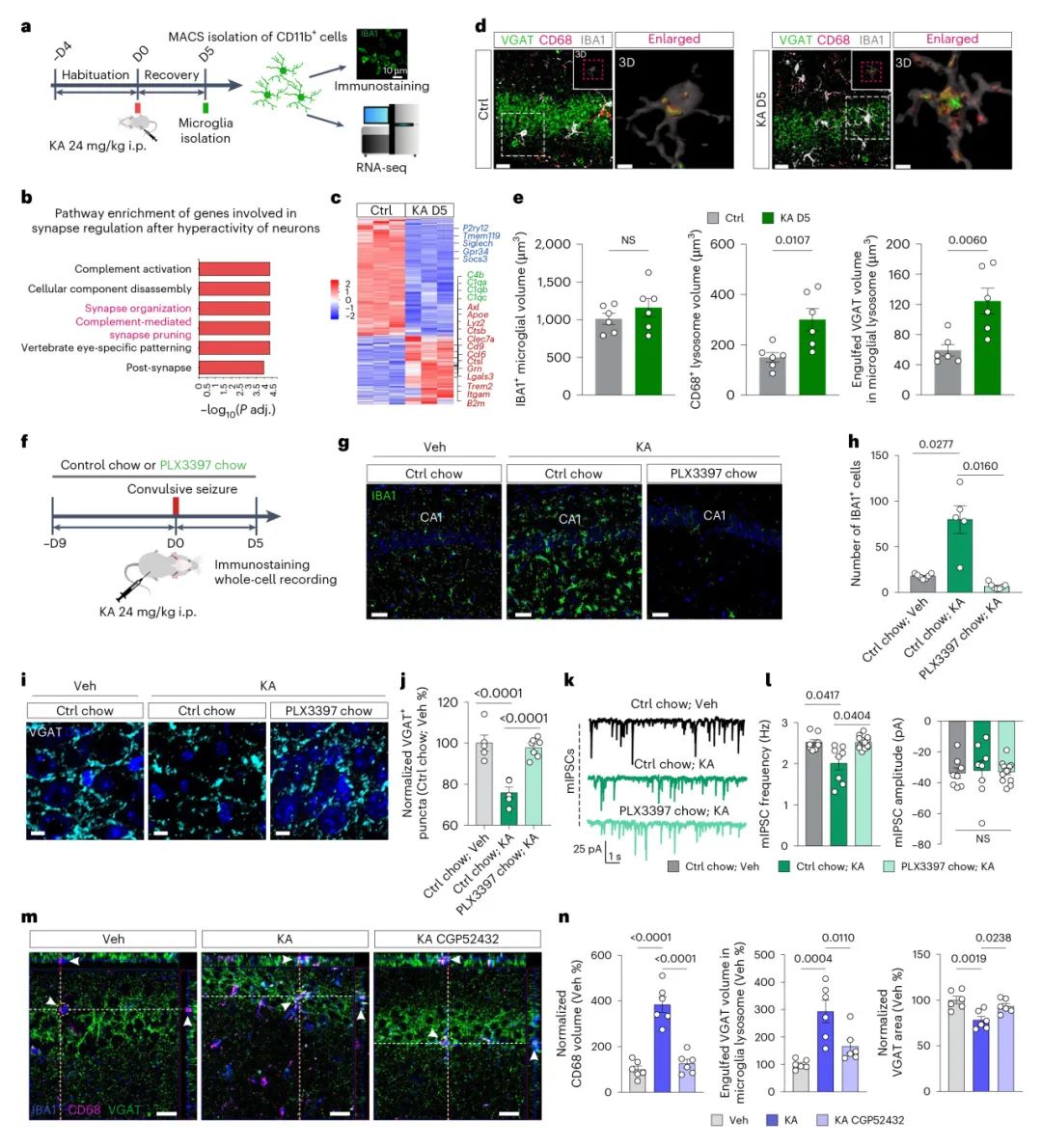
图2 小胶质细胞在癫痫发生过程中选择性地吞噬抑制突触
2、GABA和C3在TLE潜伏期协调抑制性突触的小胶质细胞吞噬
药理学抑制研究表明,GABAB受体在KA模型中介导吞噬小胶质细胞激活。免疫荧光染色证实GABAB上调KA注射后D5海马小胶质细胞中的R2亚基(由Gabbr2编码),KA刺激后D5的脑电图记录显示,Gabbr2-cKO小鼠的发作间期样放电减少,表明神经过度兴奋性降低。相比之下,AAV介导的神经元中Gabbr2的选择性敲低未能挽救抑制性突触丢失,证实了小胶质细胞GABA能信号传导在抑制性突触消除中的重要作用。小胶质细胞对突触的吞噬需要两个分子信号:一个是将小胶质细胞突起募集到目标部位(“find-me”信号,这里为GABA),另一个是标记突触以消除(“eat-me”信号)。已知补体分子可标记小胶质细胞吞噬作用的突触。补体蛋白C1q和C3与发育过程中的突触消除和神经系统疾病有关。为了确定哪些补体分子沉积在抑制性突触上,我们通过免疫染色发现KA刺激的小鼠C3沉积在VGAT抑制突触上增加,而C1q与VGAT的共定位保持不变,表明C3优先标记抑制性突触以消除。总之,这些发现表明,GABA和C3信号传导在癫痫发生的潜伏期协调小胶质细胞对抑制性突触的消除(图3)。
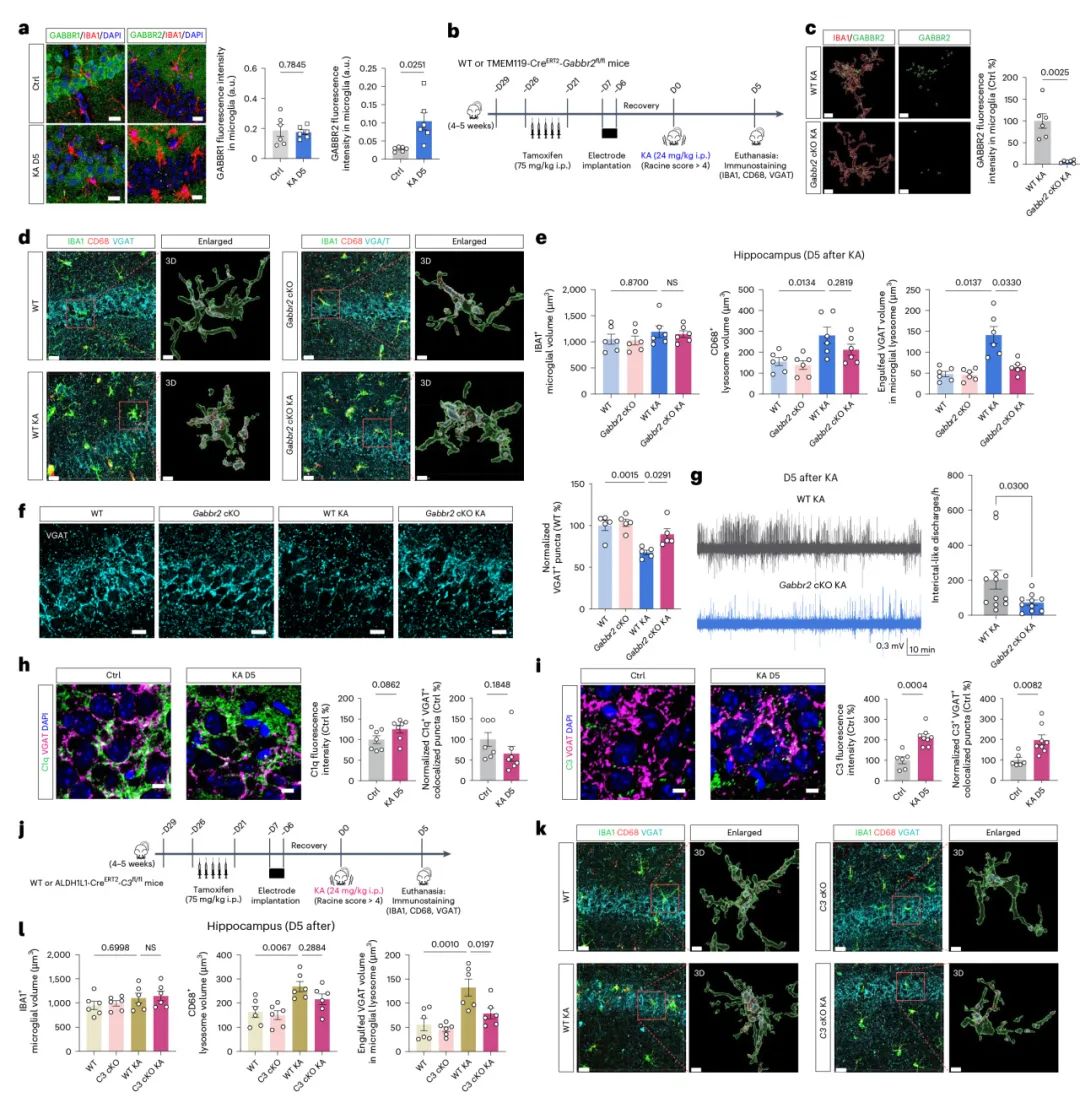
图3 GABA信号传导与补体C3协调,在KA模型的潜伏期促进抑制性突触的选择性消除
3、在慢性期阻断 C3 信号传导具有抗癫痫作用
上述实验表明阻断GABA或C3信号传导可能具有TLE的治疗潜力。然而,鉴于GABA信号转导的广泛生理作用和GABA受体的普遍分布,作者专注于靶向C3信号作为TLE的治疗策略。使用遗传学和药理学方法,作者在KA诱导的TLE的潜伏期和慢性期阻断了C3。首先,作者在ALDH1L1CreERT2-C3-cKO mice小鼠进行KA注射,并在3周后评估小鼠突触动力学和癫痫发作症状。与WT小鼠相比,C3-cKO显著抑制了抑制性突触的小胶质细胞吞噬,部分恢复了VGAT抑制突触,并挽救了海马神经元中的mIPSCs和sIPSC(图4)。
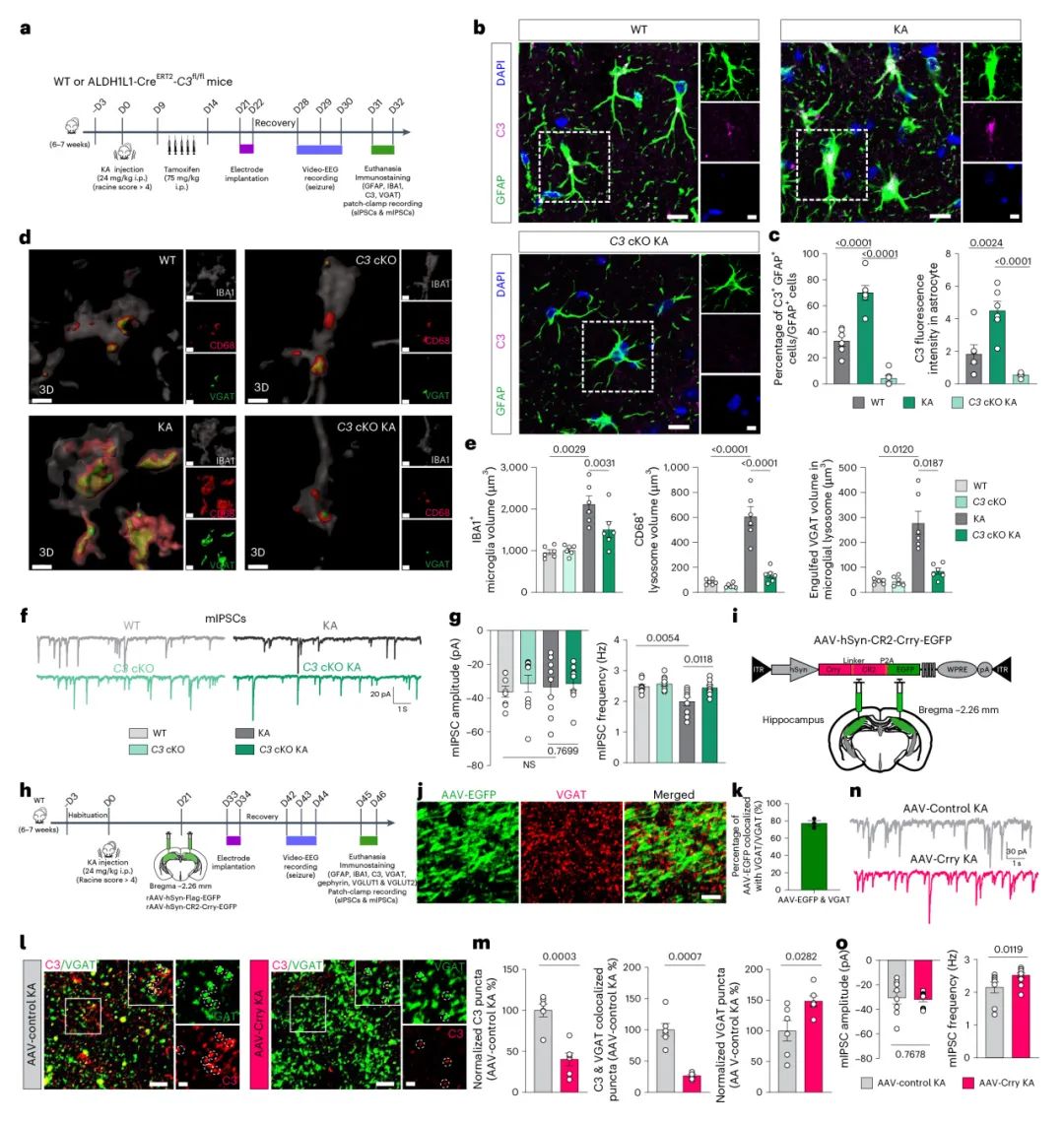
图4 在 KA 模型中,慢性期 C3 信号的遗传或药物阻断具有抗癫痫作用
对于药理学抑制,作者如上所述使用 CR2-Crry 系统,在KA后第21天递送AAV病毒。三周后EGFP信号主要与VGAT抑制性突触共定位。与AAV-EGFP对照组相比,AAV-CR2-Crry-EGFP组显示C3/VGAT共定位显著减少,以及VGAT/gephyrin 抑制突触增加。这种干预还挽救了抑制性传递受损并缓解了癫痫发作症状。总之,这些结果表明,在急性癫痫发作后阻断C3信号传导在TLE的慢性期发挥抗癫痫作用。
总结
神经元过度兴奋是许多神经系统疾病的常见病理特征。神经元-神经胶质细胞相互作用是这一过程的基础,但具体机制仍不清楚。在这里,作者揭示了小胶质细胞介导的抑制性突触选择性消除在驱动神经元过度兴奋中的关键作用。在癫痫小鼠中,过度活跃的抑制性神经元通过GABA能信号传导直接激活小胶质细胞。激活的小胶质细胞优先吞噬抑制性突触,破坏兴奋性和抑制性突触传递之间的平衡,并放大网络兴奋性。这种反馈机制取决于 GABA-GABAB受体介导的小胶质细胞激活和补体C3-C3aR介导的抑制性突触吞噬,这两种途径的药理学或化学遗传阻断可有效防止抑制性突触丢失并改善小鼠的癫痫发作症状。作者的研究结果表明,抑制性神经元可以通过反馈机制直接指示小胶质细胞状态控制抑制性突触传递,从而导致颞叶癫痫中神经元过度兴奋的发展。
参考来源: