佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Commun Biol丨组织透明化、光/化学遗传技术联用揭示调节排尿和膀胱功能关键神经元
315 人阅读发布时间:2025-06-24 10:03
排尿作为兼具生理排泄功能与社会行为意义(如动物信息素通讯)的复杂过程,其神经调控依赖于中枢系统对膀胱感觉与环境信号的整合,但具体细胞与环路机制尚不明确。近期一篇发表于《communications biology》上的文章,通过逆行跨突触追踪技术定位l/vlPAG对膀胱/尿道括约肌的支配,并整合细胞特异性活动记录(光纤光度法)、光遗传学/化学遗传学操控及膀胱-括约肌功能检测,首次揭示l/vlPAG SST⁺神经元经PAG-PMC通路调控排尿的机制,为排尿障碍治疗提供新靶点。

l/vlPAG 神经元支配膀胱和尿道外括约肌(EUS)
作者首先通过免疫荧光法,用PGP9.5标记膀胱神经元并用α-SMA标记膀胱肌层结构,并运用Fdisco组织透明化技术结合光片显微镜,对以标记好的全膀胱/EUS进行3D成像。发现神经纤维密集分布于膀胱肌层、膀胱基底部及EUS内(图1),为病毒注射提供精准靶点。
接下来,作者将伪狂犬病毒PRV-EGFP注入膀胱/EUS肌层,按时间梯度观察病毒逆向传播。观察到病毒注射48小时时,注射至膀胱的小鼠,PRV 标记的神经元主要存在于周围神经系统的主要盆腔神经节 (MPG) 和脊髓内的骶部副交感神经核 (SPN) 中,注射到EUS中的小鼠,仅在脊髓的 Onuf 核 (On) 和背灰连合 (DGC) 中观察到 PRV 标记的神经元。病毒注射72小时的两组小鼠均标记至脑桥排尿中枢(PMC)病毒注射96小时的小鼠,首次发现标记l/vlPAG神经元。因此可判断控制排尿的神经环路至少通过四级突触连接实现下行控制,且l/vlPAG为膀胱/EUS调控的高级中枢之一。
组织透明化技术使注射位点可视化,且精准定位到病毒传输的脑区。
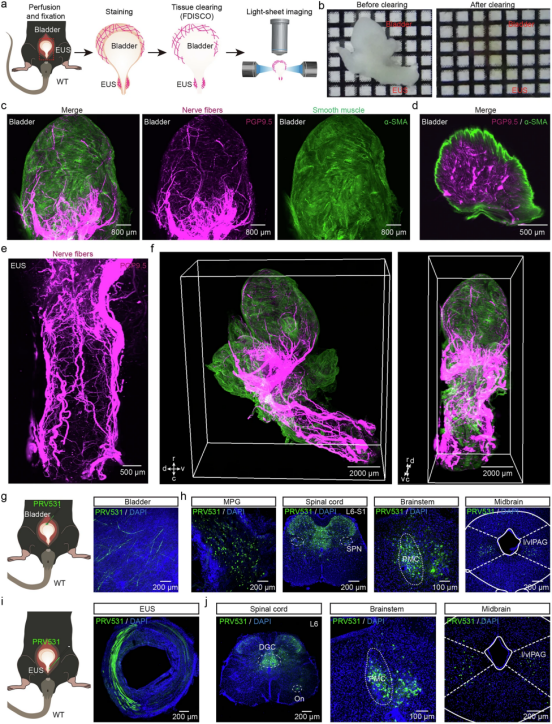
图1 膀胱和 EUS 的外周和中枢神经神经支配
排尿期间 l/vlPAG 中 SST+ 神经元的活性增加
作者运用活体钙成像技术在SST-Cre小鼠l/vlPAG注射Cre依赖性钙指示剂AAV-DIO-GCaMP6f,植入光纤记录钙信号,并腹腔注射利尿剂呋塞米增加排尿频率,同步高清摄像记录自由活动小鼠的排尿事件,且设置表达GFP的l/vlPAG SST⁺神经元小鼠为对照组排除运动伪影干扰。通过光纤光度术实时监测GCaMP6f荧光强度变化(采样率2000 Hz),后将钙信号与排尿起始时间(尿道口出现尿液)严格对齐分析,采用数据洗牌法(Shuffled data)验证信号特异性。发现实验组排尿期间GCaMP6f荧光强度显著升高(最大Δf/f = 10.83% ± 1.15%),且早于排尿起始1.6秒,并且100%排尿事件均伴随钙信号上升。对照组钙信号无变化。由此可知,l/vlPAG SST⁺神经元在排尿启动前特异性激活,其活动与排尿起始严格时间锁定(提前1.6秒),证实其作为排尿启动的关键调控节点。
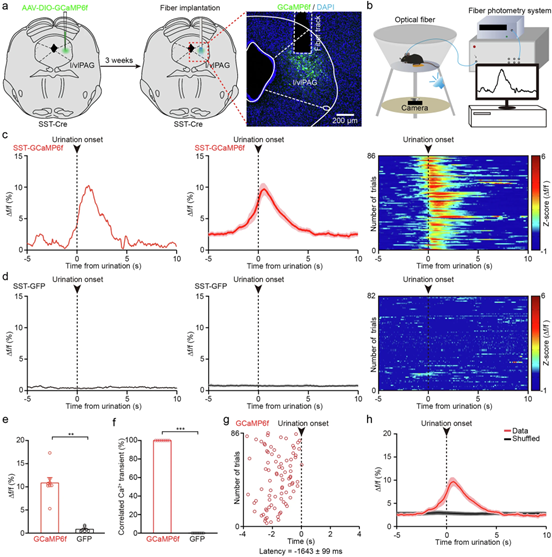
图2 l/vlPAG SST 神经元的活动与排尿高度相关
l/vlPAG SST+ 神经元的激活触发清醒和麻醉小鼠的排尿
作者通过光遗传学激活小鼠l/vlPAG SST⁺神经元(经AAV-DIO-ChR2-mCherry靶向表达及c-Fos验证),在清醒状态下成功诱导94%试验发生排尿(潜伏期2秒),在麻醉模型下引发显著膀胱压力升高(ΔP=3.59 cmH₂O, p<0.001),且该收缩效应独立于尿道括约肌(EUS)活动:空膀胱时100%诱发收缩但无EUS变化,仅在膀胱部分充盈时48%试验协同EUS松弛实现完整排尿,证实SST⁺神经元是排尿反射的特异性启动因子,其膀胱调控功能与括约肌解耦。
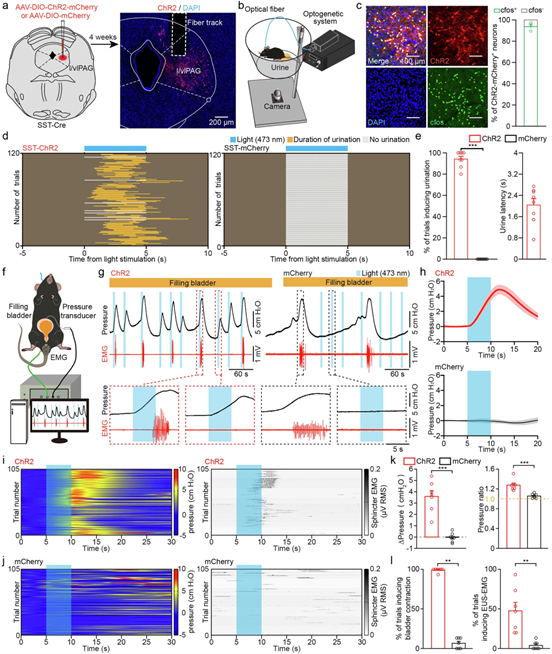
图3 l/vlPAG SST 神经元的光遗传学激活诱导清醒和麻醉小鼠排尿
l/vlPAG SST+ 神经元控制膀胱收缩
为确定l/vlPAG SST+神经元是直接调节膀胱活动还是EUS松弛,研究人员在未向膀胱灌注盐水(模拟空虚状态)的麻醉小鼠中施加了光遗传学刺激。光刺激在表达ChR2的小鼠中触发了膀胱收缩,但未伴随EUS-EMG活动的任何变化,且该现象100%发生,但对照组小鼠无明显反应。这表明激活l/vlPAG SST+神经元能特异性诱导膀胱收缩,且不依赖于EUS活动。
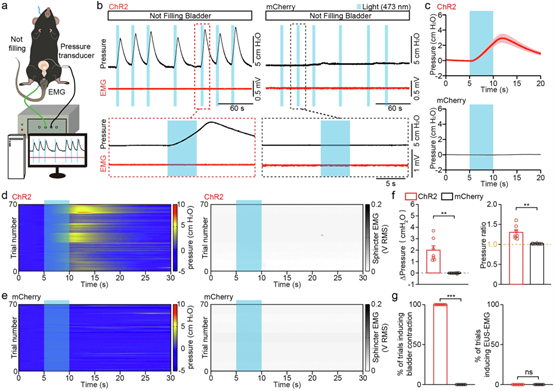
图4 l/vlPAG SST 神经元的激活触发时间锁定的膀胱收缩
抑制l/vlPAG SST+ 神经元可终止正在进行的排尿
为研究l/vlPAG SST+神经元的活动对于排尿是否必要,研究人员检测了在排尿过程中抑制这些神经元的效果。使用光遗传学在l/vlPAG SST+神经元双侧表达抑制性视蛋白GiACR1,并在排尿开始后2秒内施加持续蓝光,显著干扰了正在进行的排尿。与同一小鼠无光照(关灯试验)的自发排尿事件相比,这导致尿液沉积面积更小、排尿持续时间更短。表达mCherry的对照组小鼠则不受光照抑制影响。光照后终止排尿的潜伏期约为0.6秒,表明这些神经元是维持排尿所必需的。
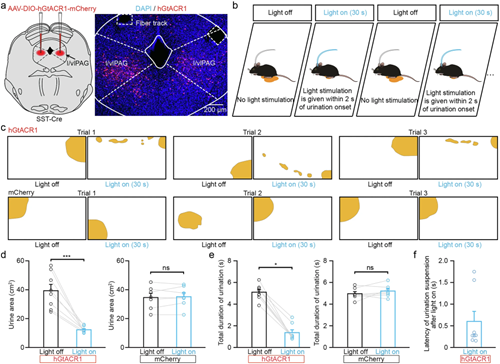
图5 l/vlPAG SST 神经元的光遗传学抑制会中断正在进行的排尿
激活投射至PMC的l/vlPAG SST+神经元可在清醒小鼠中促进排尿
顺行追踪显示l/vlPAG SST+神经元投射到多个脑区,包括脑桥排尿中枢(PMC)。从PMC进行的逆行追踪证实了l/vlPAG SST+神经元向PMC的密集投射。
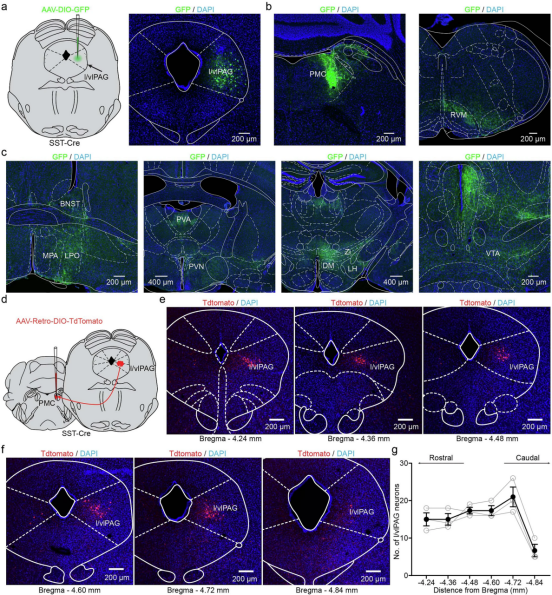
图6 l/vlPAG SST 神经元投射到 PMC
为评估这条l/vlPAG^(SST)-PMC通路的功能作用,研究人员采用了两种方法。第一种方法是化学遗传学激活(使用hM3D和CNO)投射至PMC的l/vlPAG SST+神经元,在自由活动小鼠中显著增加了排尿事件次数、总尿液面积,并缩短了排尿间隔(与盐水试验相比)且对照组小鼠无变化。第二种方法是光遗传学激活这些特定的投射神经元也能有效诱导排尿事件(成功率90%),平均潜伏期为1.9秒且对照组刺激无效。
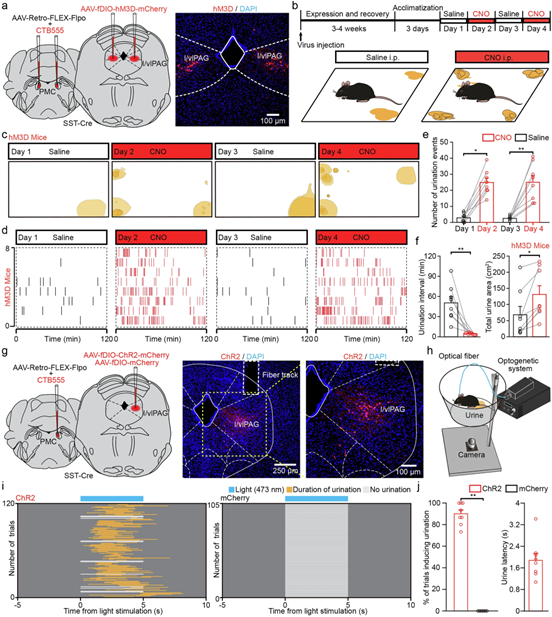
图7 PMC 投射的 l/vlPAG SST 神经元的化学遗传学或光遗传学激活促进自由移动小鼠的排尿
激活投射至PMC的l/vlPAG SST+神经元诱导的膀胱收缩依赖于盆神经
在膀胱充盈的麻醉小鼠中,光遗传学激活投射至PMC的l/vlPAG SST+神经元诱导了膀胱收缩和反射性排尿。重要的是,即使在膀胱未充盈状态下,激活这些投射神经元也能引发持续的膀胱压力升高,而不改变EUS-EMG活动,这与激活l/vlPAG胞体的效果一致。为确认该通路对外周神经的依赖性,研究人员测试了在切断盆神经(PELx,该神经携带副交感神经纤维支配膀胱)前后进行光遗传激活的效果。激活在神经完整的小鼠中始终能诱导膀胱收缩,但在PELx后这些反应完全消失。这表明激活l/vlPAG^(SST)-PMC通路诱导的膀胱收缩依赖于信号通过盆神经的传递。
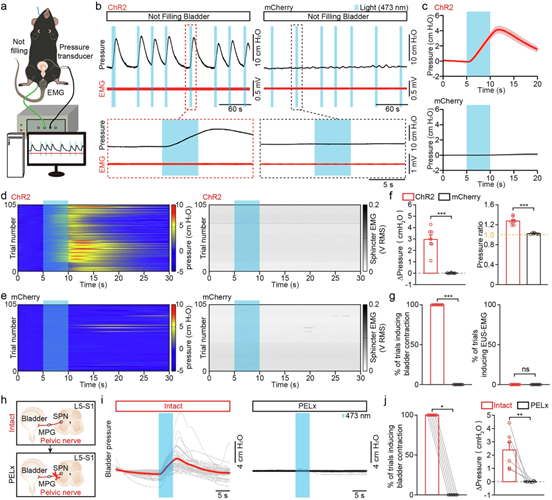
图8 激活 PMC 投射的 l/vlPAG SST 神经元驱动膀胱收缩
总结
本研究确定了l/vlPAG中的SST+神经元是小鼠膀胱功能和排尿的关键调节因子。它们的活动与排尿动作的产生紧密相关并提前出现。激活这些神经元足以在清醒小鼠中触发排尿反应,在麻醉小鼠中引发膀胱收缩,而急性抑制它们则会中止正在进行的排尿。这些神经元直接投射到PMC,操纵这条特定的l/vlPAG^(SST)-PMC通路能复制激活胞体的效果,诱导排尿和膀胱收缩。至关重要的是,膀胱收缩需要完整的盆神经。这些发现确立了l/vlPAG SST+神经元作为反射性排尿的“启动开关”,通过兴奋PMC进而协调膀胱收缩(经由盆神经)。这项工作为排尿控制的中枢细胞和环路机制提供了新见解,突显了l/vlPAG作为诊断和治疗排尿功能障碍(如尿潴留)的潜在靶点。