佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
客户文章丨FDISCO组织透明化技术助力揭示一种可用于中枢神经系统药物递送新方式
10088 人阅读发布时间:2025-07-02 15:01
The Lancet
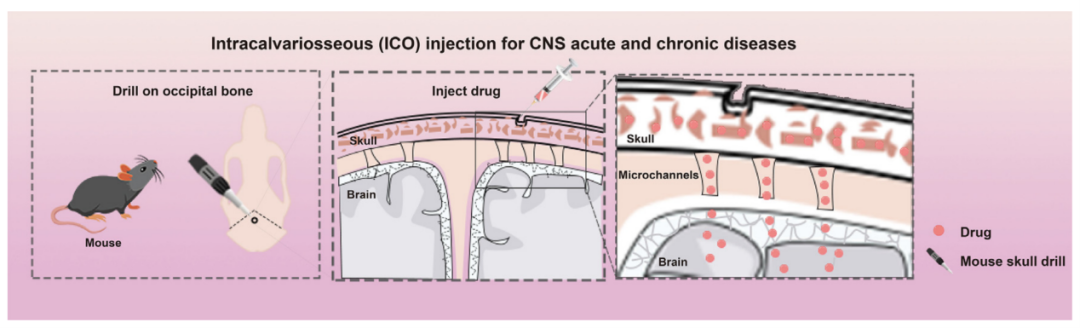
中枢神经系统(CNS)的药物递送是治疗神经系统疾病药物开发的主要障碍。现有的药物递送方法依赖于破坏血脑屏障(BBB)以使药物渗透到CNS。研究人员发现颅骨骨髓与硬脑膜之间存在天然微通道,为通过颅骨骨髓递送药物提供了途径。然而,关于这种递送方法在脑卒中药物治疗中的可行性、安全性和有效性尚未有研究。

2025年2月,北京天坛医院的王伊龙团队在《The Lancet》杂志上发表了题为“Intracalvariosseous injection: an approach for central nervous system drug delivery through skull bone marrow with a preclinical research in stroke”的研究成果。该研究采用微孔法进行颅骨内(ICO)注射,通过颅骨骨髓直接将药物递送至脑实质。通过监测颅骨和外周血中性粒细胞计数以及FITC-葡聚糖通过BBB的外渗情况评估ICO的安全性。通过透明化颅骨-硬脑膜-脑组织观察药物递送途径。在啮齿类动物脑卒中模型中,通过ICO给予神经保护剂NA-1或Y-3,通过评估神经功能缺损、梗死面积、神经炎症因子、神经元凋亡以及肝肾功能来评价其安全性和有效性。通过荧光示踪和高效液相色谱法测定组织中的药物浓度,以评估ICO的递送效率。从结果而言,ICO注射通过颅骨骨髓与硬脑膜之间的微通道将药物递送至脑实质,其递送效率高于静脉注射。ICO注射后,颅骨骨髓和外周血中性粒细胞计数无变化,FITC-葡聚糖通过BBB的量也未改变。这证实了ICO注射不会引起颅骨感染或破坏BBB,表明ICO注射安全可行。在使用神经保护剂治疗脑卒中时,尽管ICO注射的药物剂量低于静脉注射,但ICO注射后药物在脑内的积累增加,有助于修复神经损伤、减少神经元凋亡并降低炎症因子的表达。
01 颅骨内(ICO)注射可将染料分子递送至脑实质
探究颅骨骨髓-硬脑膜-类淋巴通路是否可用于药物转运,作者通过ICO注射(图1a)或静脉(IV)注射向小鼠注射5微升10% EB溶液。尾静脉注射后10分钟、30分钟和60分钟,在小鼠肢体和尾部观察到伊文思蓝,但IV组的脑组织中未观察到。ICO注射后10-60分钟,在小鼠脑内观察到伊文思蓝(图1b)。值得注意的是,当注射相同体积的EB溶液时,ICO组在所有测试脑区(如颅骨和硬脑膜、小脑、皮层、纹状体和海马)中的EB浓度均高于IV组,血浆除外(图1c)。ICO注射后EB含量在1小时达到峰值,随后逐渐下降(图1d和e)。
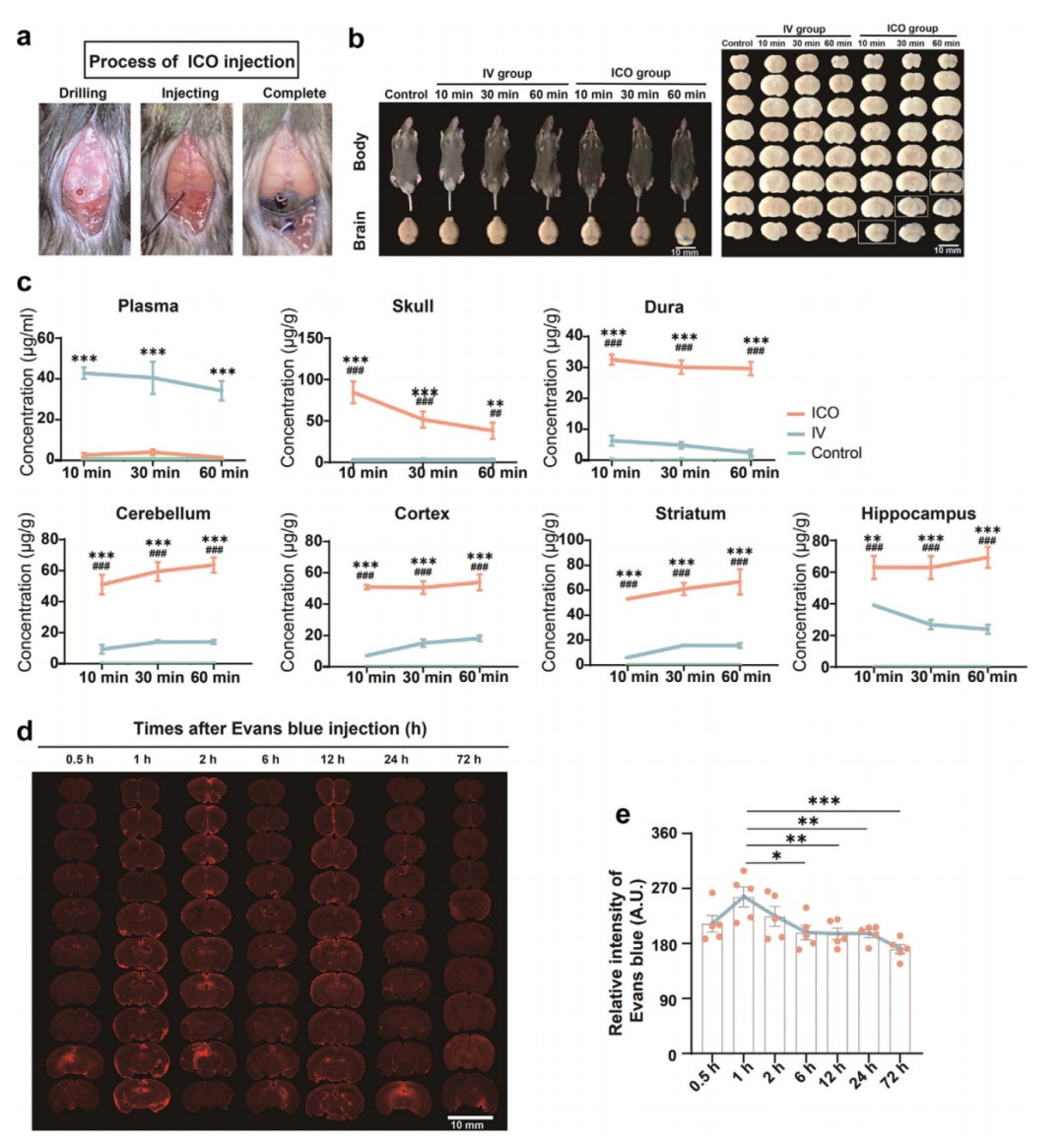
图1:ICO注射的可行性
02 ICO注射安全且不会引起颅骨感染或破坏BBB
为评估ICO注射的副作用,作者观察了注射部位周围皮肤,在假手术或pMCAO小鼠中,ICO注射24小时后注射部位未见红肿或渗出。此外,作者检测了颅骨骨髓和外周血中中性粒细胞比例及炎症细胞因子(IL-1β和TNF-α)水平(图2a和b)以评估ICO注射引起的炎症反应。流式细胞术显示,ICO注射24小时后颅骨骨髓和外周血中中性粒细胞比例无显著变化(图2c)。在ICO注射1天和3天后用ELISA检测颅骨和血清中IL-1β和TNF-α水平,无论是假手术组还是pMCAO模型组结果均无变化(补充图S1a-d)。这些结果表明ICO注射未引起颅骨感染。
当BBB开放时,物质可进入脑内。因此,作者通过注射不同分子量(4 kDa、40 kDa、150 kDa)的FITC-葡聚糖(图2d)和HRP(44k Da)检测BBB的完整性。示踪剂在血管周围的渗漏量可反映BBB通透性,作者发现假手术组和假手术-ICO组中无示踪剂渗漏,而pMCAO组中FITC荧光(图2e)和HRP的渗漏量与pMCAO-ICO组相同。4 kDa、40 kDa和150 kDa FITC-葡聚糖以及HRP的结果均支持ICO不影响BBB通透性。
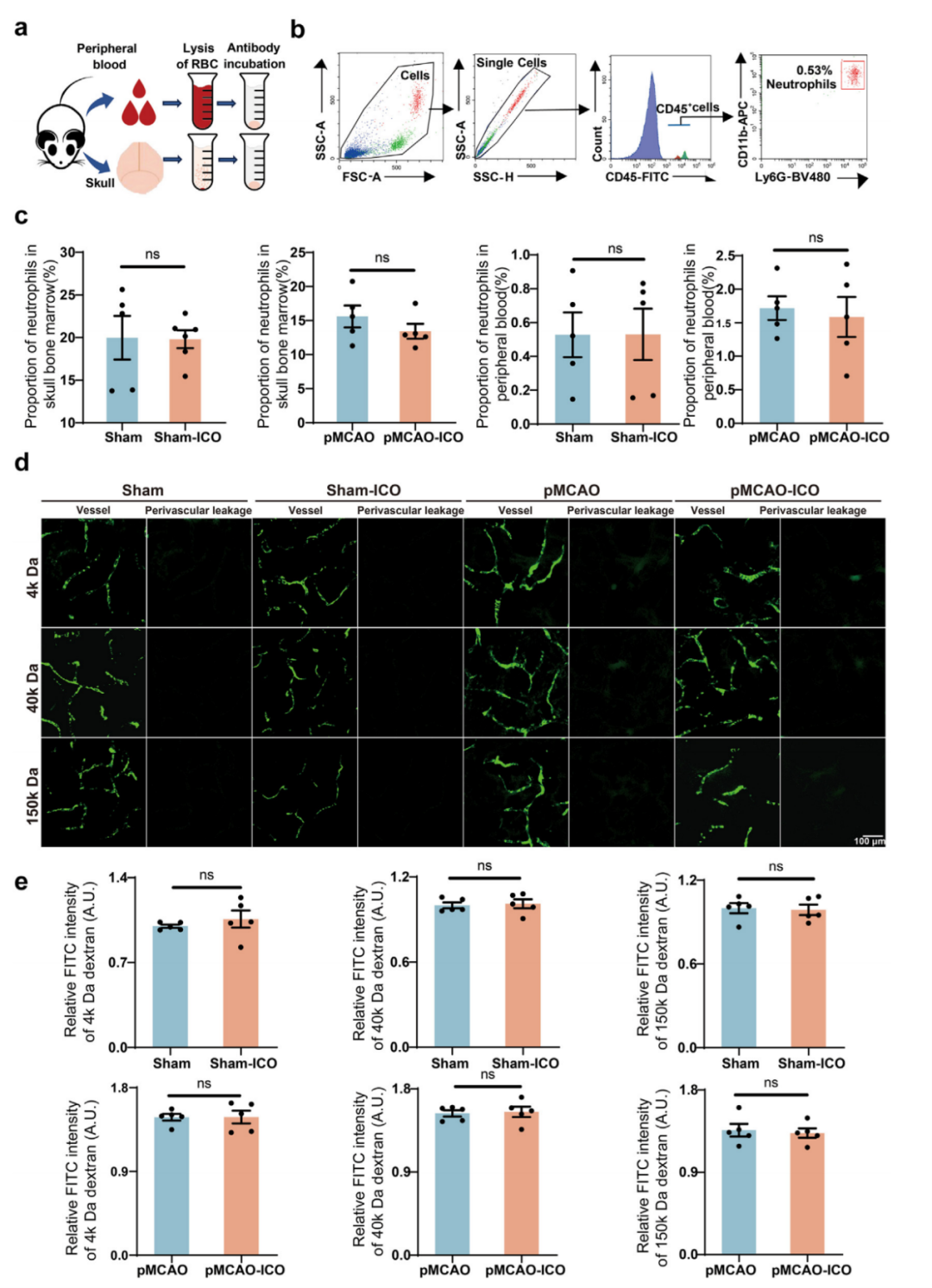
图2:ICO注射后颅骨感染和BBB完整性
03 ICO注射绕过BBB到达脑实质
为明确ICO注射至脑实质的递送途径,需全面检查颅骨、硬脑膜和脑组织。作者采用Cy3标记的多肽PSD95抑制剂NA-1。ICO注射NA1-Cy3后1小时获取颅骨-硬脑膜-脑复合体并进行组织透明化处理以缓解钙化颅骨导致的成像问题(图3a和b)。发现NA1-Cy3存在于颅骨、颅骨与硬脑膜之间的微通道、硬脑膜和脑实质中,且颅骨骨髓中的浓度高于脑实质。此外,使用Lyve1-AF488和CD31-AF647分别标记透明化组织中的脑膜淋巴管和血管,随后使用佳维斯(武汉)生物医药有限公司的FDISCO组织透明化试剂盒对颅骨和脑组织进行整体透明成像(图3b),结果发现NA1-Cy3位于脑实质周围以及颅骨髓腔和微通道中的血管周围,不与CD31共染色(黄色箭头)(图3c和d),表明荧光标记药物通过颅骨与硬脑膜之间的微通道绕过BBB进入脑实质。我们发现ICO注射药物不依赖血液途径,而是通过血管周围空间绕过BBB,这与CSF通过血管周围空间进入硬脑膜一致。
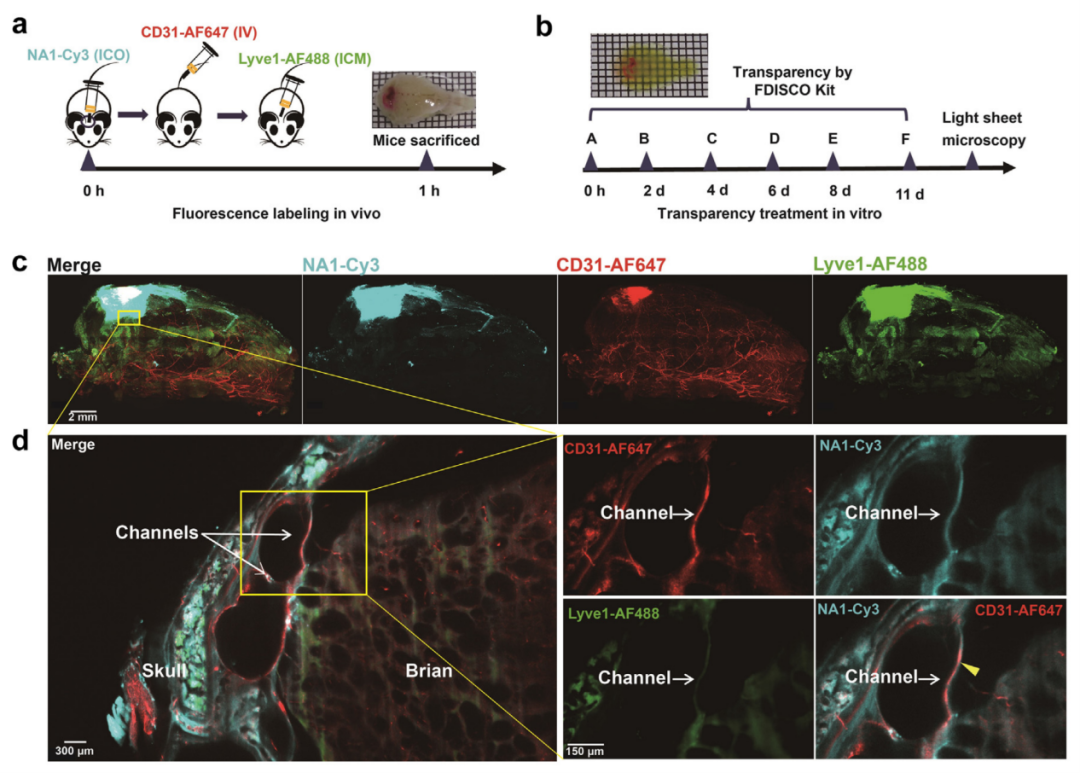
图3:通过颅骨与硬脑膜之间的微通道,由ICO注射的Cy3标记NA-1进入脑实质
04 ICO注射使用小剂量药物但增强神经保护剂NA-1和Y-3在脑卒中治疗中的疗效
在大鼠pMCAO脑卒中模型中评估了ICO注射的可行性、安全性和有效性,并选择PSD95抑制剂作为脑卒中的治疗药物。通过抑制PSD95,可破坏PSD95-NMDR-nNOS复合物的形成,从而减少神经毒性损伤。 NA-1(多肽,分子量:2518.88)和Y-3(化合物,分子量:463.13)是两种不同类型的PSD95抑制剂。临床前研究表明,在脑卒中急性期给予NA1/Y-3可大程度减少损伤。NA-1是一种20个氨基酸的多肽,通过干扰PSD95蛋白发挥神经保护作用,在临床前缺血再灌注脑卒中模型中显示出疗效。Y-3可轻松穿过血脑屏障,能选择性阻断缺血诱导的nNOS-PSD-95相互作用,在体外表现出强效神经保护活性,并可改善小鼠和大鼠MCAO及再灌注后的局灶性脑缺血损伤。给药24小时后,通过TTC染色标记脑梗死区域。与IV组相比,当NA-1或Y-3的剂量分别为3.9毫克/千克或0.1毫克/千克时,ICO组的梗死面积、mNSS评分和脑含水量更低。大鼠处理后7天内(图4a)。尽管ICO组与IV组在存活率(图4b和g)或体重变化(图4c和h)上无差异,但Y3-ICO组在第1天和第3天的神经功能评分更好(图4d),且在第3天和第5天的旋转棒测试中掉落时间更长(图4e)。此外,NA1-ICO组在第1天的神经功能缺损更轻(图4i),且第7天的旋转棒测试掉落时间更长(图4j)。我们还观察到,与IV注射相比,ICO注射Y-3(图4f)和NA-1(图4k)分别使脑梗死面积减少40%和37%。此外,我们评估了不同注射组的肝功能(补充图S3a)和肾功能(补充图S3b),发现ICO组与IV组之间无差异。这些数据表明,ICO注射神经保护剂作为脑卒中治疗方法是可行、安全且高效的。
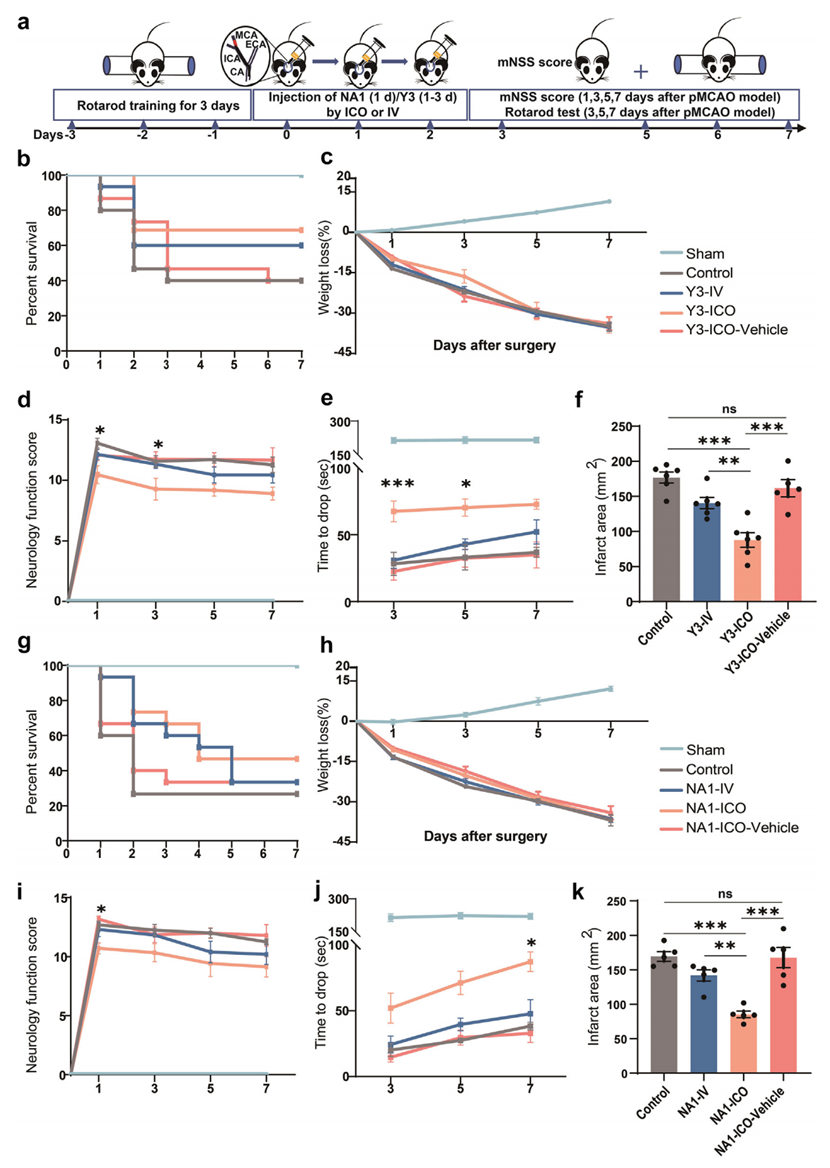
图4:神经保护剂NA-1/Y-3在pMCAO模型中的疗效
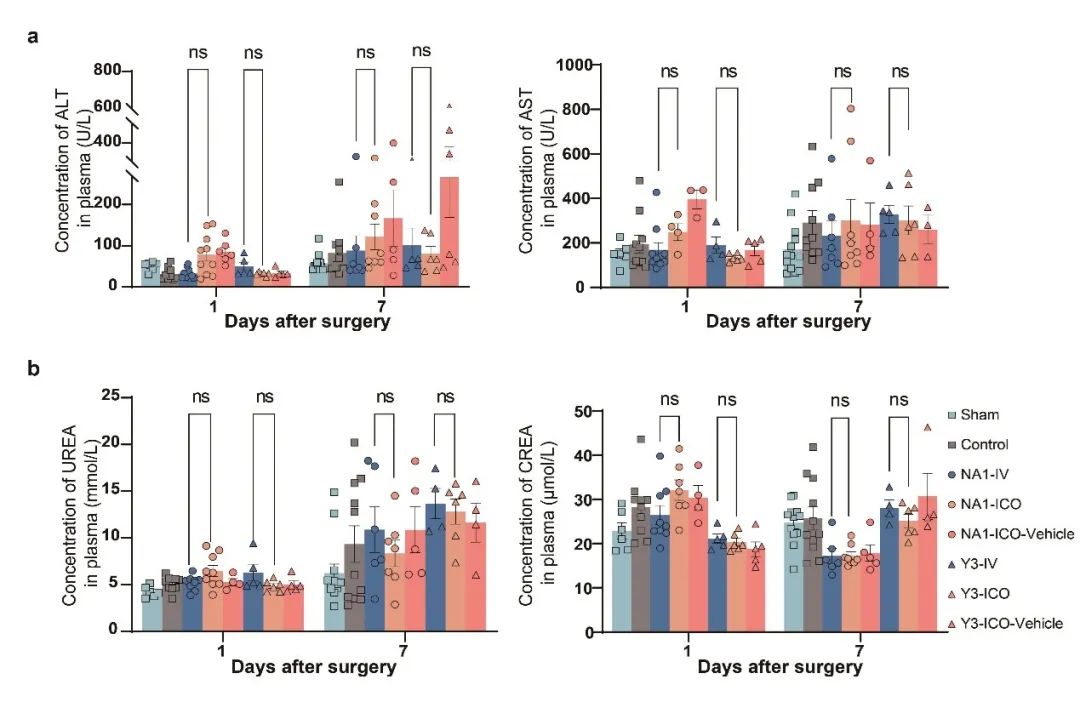
图S3:ICO注射后肝肾功能
05 ICO注射促进药物暴露,从而进一步减少用药后的炎症和细胞凋亡
通过高效液相色谱(HPLC)检测IV/ICO注射后组织中Y-3的浓度。发现脑卒中模型中,ICO组血浆Y-3浓度在注射后1-4小时低于IV组(图5a)。此外,组织与血浆分配系数(Kp)显示的Y-3分布表明,ICO组在颅骨、硬脑膜和CSF中呈下降趋势(图5b),而在小脑、皮层、纹状体、海马和深部颈淋巴结中呈上升趋势(图5c)。我们使用FITC标记的NA-1和Y-3观察ICO注射的药物量,发现IV组大部分FITC药物保留在血管中,而ICO组药物进入神经元(图5d和g)。这表明与IV组相比,ICO导致FITC分子数量(图5e和h)和细胞内摄取FITC的神经元数量(图5f和i)增加。由于PSD95抑制剂可解耦PSD95和NMDR,并抑制脑卒中后nNOS的表达,我们在注射NA-1/Y-3后24小时检测pMCAO模型脑组织中的nNOS(补充图S4a)。荧光强度的半定量分析表明,ICO注射NA-1/Y-3后脑组织中nNOS的表达降低(补充图S4b)。脑卒中后,神经元因缺血缺氧逐渐发生程序性死亡。通过Capase3和NeuN免疫荧光染色共标记pMCAO模型中的凋亡神经元(补充图S4c)。数据显示,第7天颅骨骨髓注射Y-3后凋亡细胞和凋亡神经元减少(补充图S4d)。简而言之,ICO注射PSD95抑制剂似乎减少了脑卒中后nNOS的表达和随后的神经元凋亡。
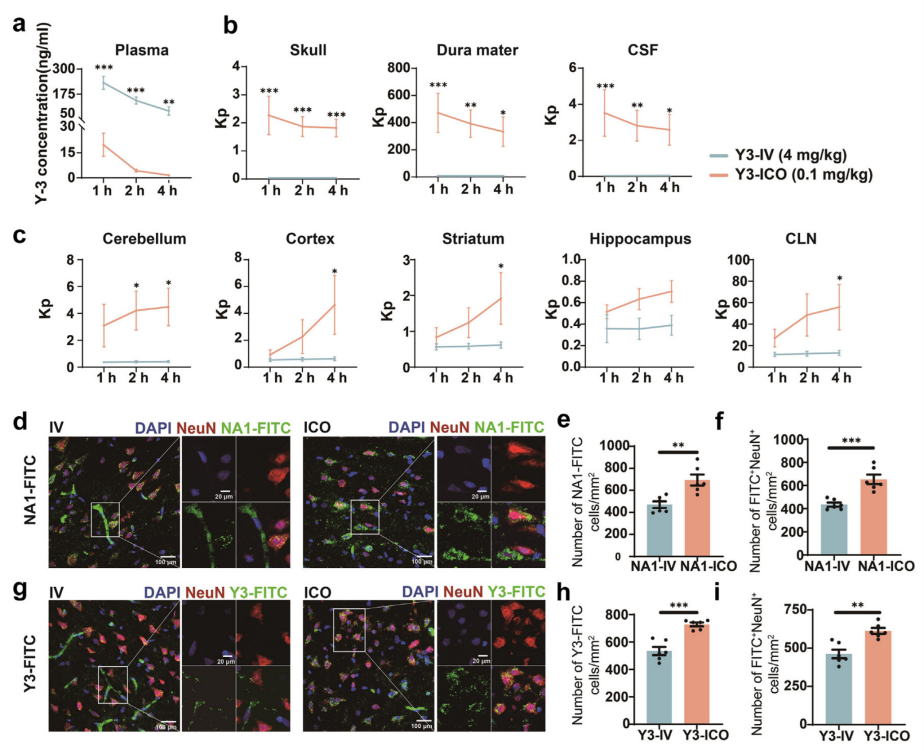
图5:脑组织中NA-1/Y-3药物水平的定量分析
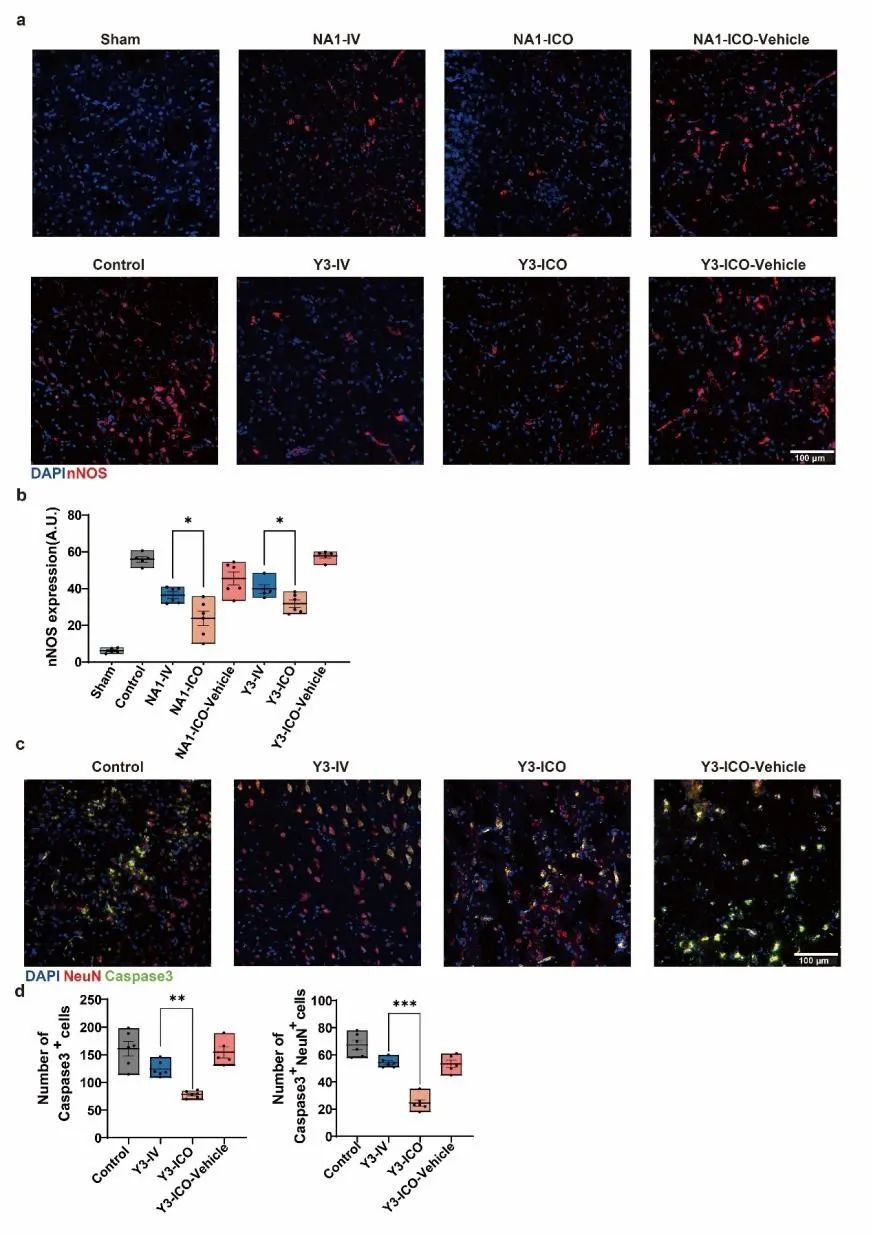
图S4:pMCAO模型中ICO注射后nNOS表达及细胞凋亡的评估
总结
颅骨与脑膜间物质交换微通道的发现,使颅骨内注射(ICO)成为潜在的脑部药物递送途径。然而,目前鲜有研究探索ICO在疾病治疗中的应用。本研究通过单孔注射技术优化ICO方法,最大限度减少颅骨损伤,同时更好地保护中枢神经系统免疫环境——考虑到颅骨是脑实质髓系细胞的重要储备库。作者通过在急性缺血性脑卒中动物模型中经ICO给予神经保护剂,系统评估了该技术的安全性和有效性。
中枢神经系统药物开发的核心挑战在于脑组织药物可及性受限。传统方法通过增加整体剂量突破血脑屏障,但会加剧外周毒性。本研究发现,ICO注射NA-1和Y-3仅需静脉注射剂量的50%和2.5%,即通过FITC标记和HPLC检测证实可显著提升脑实质药物暴露。这种低剂量高递送效率的特性,对静脉注射治疗窗较窄的药物尤其具有临床价值。ICO的高效性可能源于药物直接进入血管周隙,而非像静脉给药那样需要穿越血脑屏障。与既往BBB开放技术不同,ICO通过颅骨-硬脑膜微通道完全规避血脑屏障,实现药物直达脑部血管周隙。值得注意的是,ICO溶剂组与对照组的梗死面积无统计学差异,但与ICO给药组存在显著区别,证实ICO本身无治疗作用,其价值在于通过提升药物脑内渗透增强疗效。尽管是侵入性操作,但仅造成0.5-1mm的枕骨微创孔洞,未引发局部或全身炎症反应。
ICO为中枢神经系统药物递送提供了革新性解决方案:既降低所需剂量又保持BBB完整性,有利于维持脑内稳态。其操作简便,建立注射位点仅需2分钟,根据药量不同全程耗时10-30分钟,这种特性使其同时适用于慢性(脑膜炎/癫痫/脑肿瘤等)和急性(脑卒中/创伤性脑损伤等)CNS疾病的治疗。基于这些优势,ICO的SOLUTION临床试验(ClinicalTrials.gov标识号:NCT05849805)已于2023年注册,特别为高外周毒性药物的CNS递送提供了新选择。但同时本研究也存在若干局限:首先,脑脊液动力学受睡眠节律、动脉搏动及CNS病理状态影响[33,34],可能改变脑膜淋巴管功能,需在不同生理病理条件下进一步验证ICO有效性;其次,相当比例药物滞留颅骨骨髓,可能限制脑实质递送效率,未来需优化减少药物残留的策略;最后,颅骨-脑膜微通道存在细胞迁移现象,需评估ICO是否影响该生理过程,后续研究应关注颅骨骨髓细胞的参与及其迁移影响。改良的ICO注射术通过简易操作快速实现BBB规避给药。本研究在生理状态和缺血性脑卒中模型中验证了其安全性、可行性和有效性,为临床转化奠定基础。