佳维斯(武汉)生物医药有限公司
3 年
手机商铺
- NaN
- 0.9000000000000004
- 0.9000000000000004
- 1.9000000000000004
- 0.9000000000000004
推荐产品
公司新闻/正文
Nature丨颠覆认知!组织透明化成像首次揭示中性粒细胞介导血管阻塞、肿瘤坏死及转移进程
229 人阅读发布时间:2025-09-26 09:51
肿瘤坏死是重要的预后指标,但其具体机制及对癌细胞的作用仍不明确。传统观点认为,肿瘤坏死是由于癌细胞增殖过快导致局部营养耗竭而形成的被动过程,因此长期以来被视为不可干预的病理现象。然而,近年研究发现,肿瘤可通过主动调控宿主生理状态(尤其是造血系统)来促进坏死形成。
在肿瘤进展过程中,宿主的造血功能会发生显著改变,表现为造血输出增加和髓系细胞分化优势(髓系偏斜)。其中,中性粒细胞(多形核白细胞,PMNs)因其在癌症转移中的关键作用而备受关注。中性粒细胞可释放中性粒细胞胞外诱捕网(NETs),这是一种由DNA和颗粒蛋白组成的网状结构,原本用于抵御病原体,但在肿瘤微环境中却可能促进转移。NETs不仅能够直接支持癌细胞扩散,还会在血管内形成时引发血栓,导致局部缺血和坏死。尽管已知NETs与癌症相关血栓及组织坏死密切相关,但其是否主动驱动肿瘤坏死并进一步影响转移进程,仍有待深入研究。

近日,发表于《自然》(Nature)杂志的研究“Neutrophils drive vascular occlusion, tumour necrosis and metastasis”,由美国冷泉港实验室等机构的科学家完成。该研究深入揭示了中性粒细胞如何通过引发血管堵塞驱动肿瘤坏死,并进一步促进肿瘤转移,为理解肿瘤进展机制及开发新疗法提供了重要视角。
01 中性粒细胞阻断血管灌注引起组织坏死
多项研究表明,原发性肿瘤坏死与多种癌症的不良预后相关。作者通过对200例乳腺癌患者的磁共振成像(MRI)分析发现,存在肿瘤坏死的患者无复发生存期和总生存期更短,且腋窝淋巴结肿大发生率更高(提示区域淋巴结转移)。
为探究乳腺癌坏死与预后的关系,作者采用组织透明化成像技术对原位植入三阴性乳腺癌(TNBC)4T1细胞的小鼠模型进行分析。坏死区域表现为核形态破坏、血管缺失及中性粒细胞大量浸润(扩展数据图1b,c)。通过成像质谱流式技术确认,这些浸润细胞确为中性粒细胞。坏死区及周边存在丰富的中性粒细胞胞外诱捕网(NETs),其特征为髓过氧化物酶(MPO+)、瓜氨酸化组蛋白3(citH3+)和DNA(DAPI+)共定位(图1a,b)。这种坏死的空间构型复杂,与传统"远离血管的中央坏死核心"理论不符(图1b),作者将其命名为"多形性坏死"。
在其他肿瘤模型(C57BL/6小鼠Lewis肺癌、FVB/n背景C3(1)-Tag自发乳腺癌模型)中也观察到类似的多形性坏死结构和血管内中性粒细胞/NETs聚集,但MMTV-PyMT模型未见此现象。值得注意的是,4T1肿瘤多形性坏死区血管内存在中性粒细胞/NETs聚集(图1c,d)。通过静脉注射罗丹明标记凝集素进行血管灌注实验显示,中性粒细胞聚集下游血管无灌注(图1e),且聚集数量与无灌注血管范围(图1f)及局部缺氧程度正相关,提示中性粒细胞通过阻塞血管引发缺血性坏死。
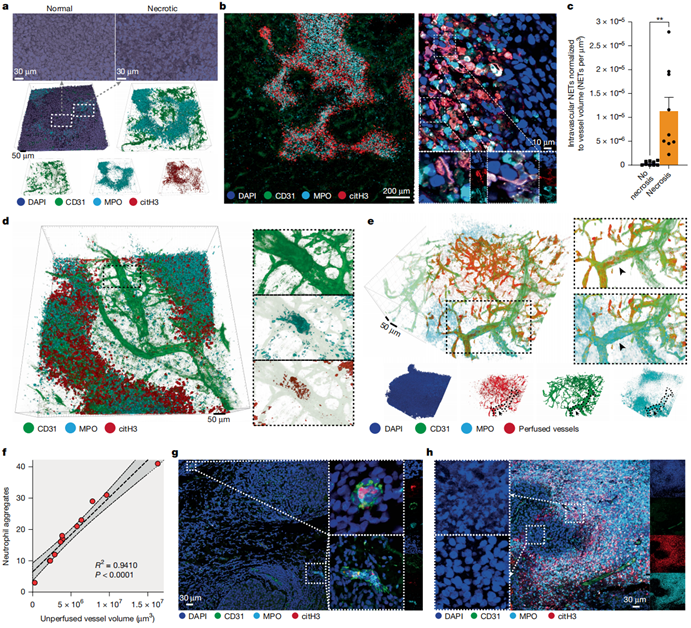
图1:验证坏死区域与血管阻塞的关系
02 坏死周边区域获得促转移特性
肿瘤坏死在癌症患者和动物模型中均与转移相关,但坏死癌细胞本身无法转移,因此我们重点分析了坏死周边区域的变化。值得注意的是,多形性坏死肿瘤的周边区域比传统中央坏死肿瘤更广泛(扩展数据图4a)。缺氧区域几乎全部位于坏死周边(图2a),因此我们以缺氧作为坏死周边的标志。在4T1肿瘤单细胞RNA测序(scRNA-seq)数据中,缺氧癌细胞除表达Hif1a和Vegfa外,还高表达Cxcl1、Ddit4、Egr1(诱导TGFβ表达)、Mcl1、Tnc(促进肿瘤迁移)、Limd1(抑制E-cadherin表达)和Ltbp1(增强TGFβ活性并促进上皮-间质转化(EMT))。基因本体分析显示缺氧癌细胞差异表达基因涉及迁移、TGFβ信号和EMT通路。在C3(1)-Tag肿瘤scRNA-seq数据中也发现类似基因变化。
通过检测EMT标志物发现,4T1、LLC和C3(1)-Tag肿瘤坏死周边区域E-cadherin表达降低而vimentin升高(图2b-g)。人类TNBC单细胞测序数据和穿刺活检结果与此一致(图2h-k)。所有转录组分析均显示TGFβ响应特征,且TGFβ蛋白在4T1肿瘤坏死周边缺氧区域富集。
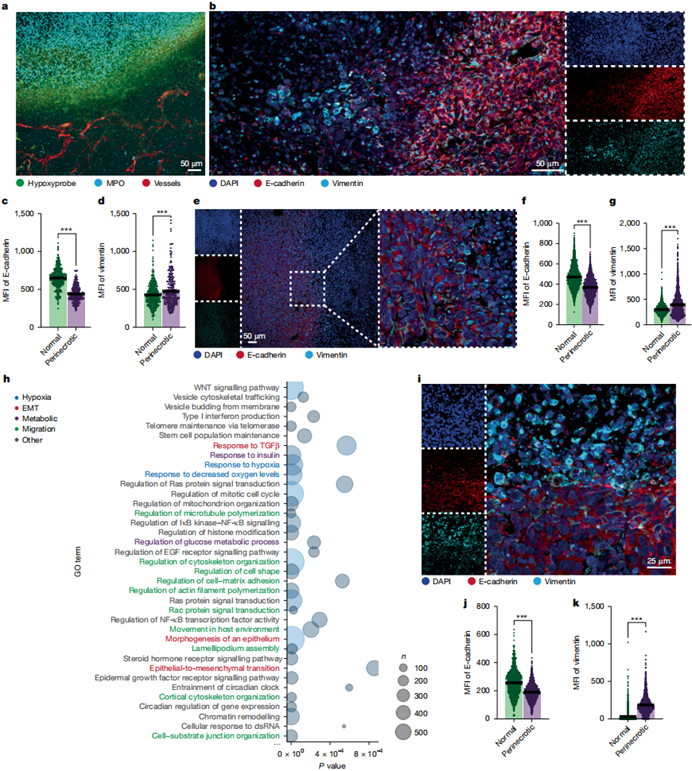
图2:探究坏死周围癌细胞的转移特性
4T1肿瘤空间转录组分析明确区分了坏死区、周边区和非坏死区(图3a-c),周边区特异性高表达EMT相关基因Vim和Twist1(图3d-e),通路富集分析证实缺氧、迁移和EMT相关通路激活(图3f)。人类非小细胞肺癌数据分析显示,中性粒细胞富集区(代表坏死区)附近的癌细胞同样呈现促转移转录特征。
为验证TGFβ的作用,我们构建了表达显性负性TGFβ受体(dnTGFβR2)的4T1细胞。虽然dnTGFβR2肿瘤的坏死程度和NETs形成未受影响(图3g-h),但周边区EMT标志物改变消失,肺转移显著减少(图3i)。通过多组学技术证实,坏死周边区TGFβ主要由巨噬细胞分泌。
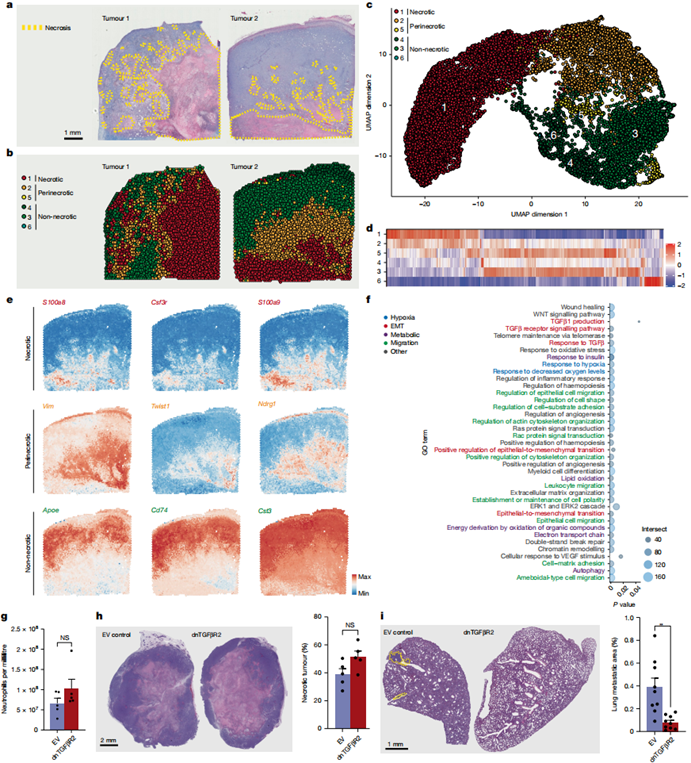
图3:解析坏死相关转录程序
03 肿瘤诱导血管限制性中性粒细胞
在荷瘤小鼠中性粒细胞的表型改变中,最令人意外的是血液中出现Ly6G高Ly6C低的亚群(中性粒细胞通常高表达Ly6C,但低于单核细胞)。这种Ly6C低中性粒细胞仅存在于4T1和LLC荷瘤小鼠(图4a)。通过RNA-seq分析发现,Ly6C低中性粒细胞高表达Cyria(Rac1抑制剂)、Dok1(抑制整合素活化)、Icam1(细胞黏附分子)、Itgax(CD11c)和Itga4(纤连蛋白受体),低表达Ly6c1/2等基因(图4b)。基因本体分析显示差异基因涉及炎症反应、翻译调控及细胞迁移通路,而外渗相关通路显著下调(图4c)。流式检测证实Ly6C低中性粒细胞表面CD62L、SiglecF、CXCR2、CXCR4、ICAM1和CD11c表达改变。
时序分析显示,Ly6C低中性粒细胞在4T1细胞植入后第9天即出现(4,595±379个/毫升血液),与原发性肿瘤多形性坏死发生同步(图4d)。该群体核形态成熟,吞噬和活性氧产生能力正常,但经PMA刺激后更易形成NETs(图4e)。在腹膜炎模型中,Ly6C低中性粒细胞表现出外渗缺陷(图4f-g),活体显微观察也显示其组织浸润能力降低,但其循环半衰期延长至28.8小时(Ly6C高群体为14.6小时)。抗体阻断实验证实Ly6C直接调控外渗过程。
由于Ly6C低中性粒细胞高表达纤维蛋白原受体CD11c和ICAM-1,其纤维蛋白结合能力增强,与血小板聚集及NETs形成效率更高。值得注意的是,Ly6C中群体表现出中间表型:虽保留部分外渗能力,但纤维蛋白黏附和NETs形成倾向与Ly6C低群体相似。这些数据支持Ly6C低中性粒细胞通过黏附血管内纤维蛋白/基底膜成分、与血小板互作及形成NETs,最终导致血栓炎性血管闭塞的模型。
Cxcl1敲除荷瘤小鼠循环Ly6C低中性粒细胞减少,伴随肿瘤坏死和肺转移减轻,而dnTGFβR2肿瘤不影响该群体,提示其位于TGFβ信号上游。人类乳腺癌scRNA-seq数据分析发现,与小鼠Ly6C低特征匹配的中性粒细胞亚群(cluster 3)主要存在于血液而非肿瘤组织(图4h-i),同样显示外渗能力下降(图4j)。
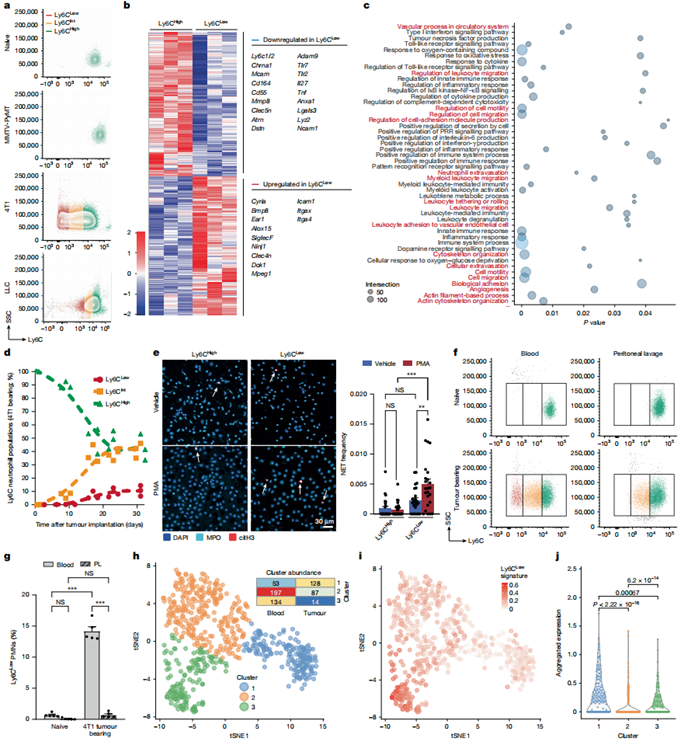
图4:鉴定促坏死中性粒细胞亚群
04 阻断NETs可减少肿瘤坏死和转移
NETs(中性粒细胞胞外诱捕网)在包括癌症在内的多种疾病中可诱发血管阻塞。鉴于Ly6C低中性粒细胞具有血管限制性且更易形成NETs,加之血管内NETs聚集确实阻塞血流,我们假设NETs的血管内释放驱动了原发性肿瘤的血管阻塞(继而导致多形性坏死)。
为验证该假说,我们构建了中性粒细胞特异性缺失PAD4(NETs形成关键酶)的小鼠模型(MRP8Cre;Padi4fl/fl,简称PAD4ΔN)。将LLC癌细胞移植至PAD4ΔN与野生型(PAD4WT)小鼠4周后,尽管肿瘤体积差异不大,但PAD4ΔN小鼠肿瘤中瓜氨酸化NETs完全缺失。关键的是,PAD4ΔN小鼠肿瘤在中性粒细胞富集区未出现血管损伤,而野生型小鼠肿瘤坏死面积高达60%(图5a-d)。肺转移分析显示,PAD4ΔN小鼠转移灶数量和负荷显著降低,但病灶平均大小不变(图5e-h)。通过尾静脉注射实验证实,这种差异源于原发瘤释放的癌细胞减少,而非转移灶生长受限。
RNA-seq分析表明,野生型小鼠坏死周边区域的癌细胞高表达Cxcl1、Cxcl2、Ncam1和Rhoq等基因,涉及代谢重编程、细胞迁移和EMT通路(图5i)。PAD4ΔN小鼠肿瘤中EMT标志物(vimentin升高/E-cadherin降低)的改变完全消失。为排除PAD4非依赖性NETs的影响,使用DNase I处理同样减少肿瘤坏死和转移。进一步采用FDA批准药物双硫仑(可阻断NETs形成)干预,证实其能降低4T1肿瘤NETs水平、减少坏死和肺转移,但不影响原发瘤生长或转移灶大小。
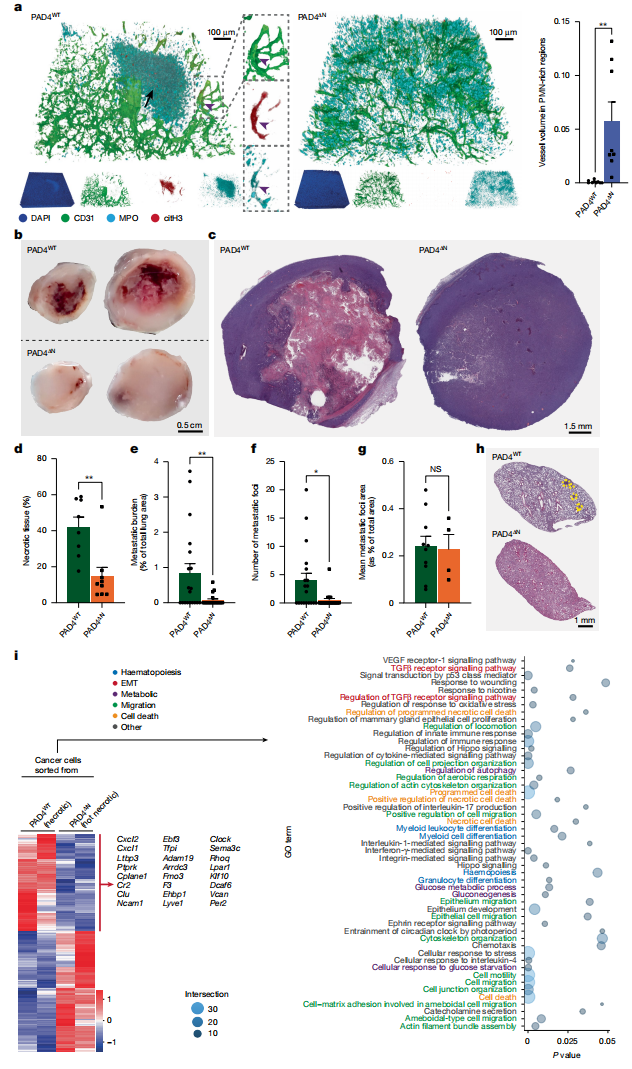
图5:鉴定促坏死中性粒细胞亚群和验证NETs驱动坏死和转移
总结
肿瘤坏死通常与癌症不良预后相关,传统观点认为其是肿瘤生长超过营养供给的被动结果。然而,本研究发现中性粒细胞可主动诱导肿瘤坏死。在多种小鼠癌症模型中,我们发现肿瘤可诱发一类Ly6G高Ly6C低的中性粒细胞亚群,这类细胞虽无法响应炎症刺激外渗,但比经典Ly6G高Ly6C高中性粒细胞更高效形成中性粒细胞胞外诱捕网(NETs)。这些"血管限制性"中性粒细胞的存在与小鼠肿瘤中"多形性"坏死结构的出现密切相关。在多形性坏死肿瘤中,血管内中性粒细胞与NETs聚集导致血管阻塞,引发下游血管床缺氧和坏死。进一步研究发现,坏死周边区域的癌细胞会发生上皮-间质转化(EMT),这解释了肿瘤坏死为何矛盾地促进转移。通过基因或药物手段阻断NETs形成,可显著减少肿瘤坏死范围和肺转移。因此,本研究证实NETs通过驱动血管阻塞、多形性坏死和转移,表明肿瘤坏死并非仅是肿瘤生长的被动副产品,且可通过干预NETs来抑制转移扩散。该研究颠覆了肿瘤坏死是"被动营养耗竭结果"的传统认知,揭示中性粒细胞亚群(Ly6G高Ly6C低)通过形成NETs主动诱导血管阻塞和坏死。